Энзимы микрофлоры сырого молока (часть 2)
Большинство нейтральных и щелочных протеиназ псевдомонад относится к классу металлопротеиназ, нуждающихся в дивалентных катионах (Со2+, Ca2+); при гидролизе белков они образуют гидрофобные пептиды, обладающие горьким вкусом. Следующие оптимальные параметры были получены для действия протеолитических систем Ps. fluorescens: температура 46-48° С, pH 7,5-7,9. Со2+(25 ммоль) повышал их активность в 11-12 раз, Ca2+ оказывал небольшое стимулирующее действие, Zn2+и Hg2+ снижали активность на 40%. В характерных для сыров условиях они сохраняют высокую активность. Протеиназы различных штаммов псевдомонад мало отличались по типу расщепляемых связей, но сильно отличались по активности.
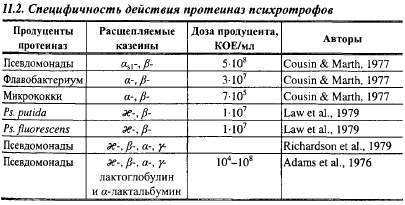
Псевдомонады расщепляют все казенны: один штамм Ps. fluorescens за 2 сут при 5° С расщепил 60% æ-, 39% β- и 23% αs1-казеина. В табл. 11.2 показано действие психротрофов на фракции казеина.
При длительном культивировании начинается автолиз клеток псевдомонад и в среду выделяются внутриклеточные протеиназы. Данных о термоустойчивости внутриклеточных протеолитических энзимов псевдомонад и возможности их участия в созревании сыров обнаружить не удалось.
Gobletti et al. доказали, что очищенная аминопептидаза из Ps. fluorescens расщепляет синтетические горькие пептиды (не все) и горькие пептиды энзиматического гидролизата молока, пастеризованного при ультравысоких температурах. Специфический профиль пептидных связей аминопетидазы, включающий аминокислоты Лей, Трп, Вал -главные компоненты горьких пептидов, доказывает ее «антигорькую» направленность. В итальянском мягком сыре Качиотта активность аминопептидазы сохраняется в течение 2-х мес.
Ps. fluorescens образует фосфолипазы, катализирующие гидролиз фосфолипидов - компонентов оболочки жировых шариков; в результате гидролиза разрушаются оболочки жировых шариков, и молочный жир становится более чувствительным к химическому окислению и действию липаз.
- Энзимы микрофлоры сырого молока (часть 1)
- Природные энзимы молока для твердых сыров (часть 3)
- Природные энзимы молока для твердых сыров (часть 2)
- Природные энзимы молока для твердых сыров (часть 1)
- Общие положения формирования твердых сыров (часть 7)
- Общие положения формирования твердых сыров (часть 6)
- Общие положения формирования твердых сыров (часть 5)
- Общие положения формирования твердых сыров (часть 4)
- Общие положения формирования твердых сыров (часть 3)
- Общие положения формирования твердых сыров (часть 2)
- Общие положения формирования твердых сыров (часть 1)
- Влияние соли на показатели (часть 2)
- Влияние соли на показатели (часть 1)
- Рассол для посолки сыров
- Абсорбция соли сыром (часть 4)
- Абсорбция соли сыром (часть 3)
- Абсорбция соли сыром (часть 2)
- Абсорбция соли сыром (часть 1)
- Посолка сухой солью и инъекционными способами
- Частичная посолка в зерне
- Посолка в рассоле (часть 3)
- Посолка в рассоле (часть 2)
- Посолка в рассоле (часть 1)
- Полная посолка в зерне (часть 3)
- Полная посолка в зерне (часть 2)
- Полная посолка в зерне (часть 1)
- Посолка молока
- Способы посолки сыров (часть 2)
- Способы посолки сыров (часть 1)
- Активность воды (часть 2)
