Молокосвертывающие энзимы (часть 2)
Химозин и свиной пепсин в сыре образуют при расщеплении αs1-казеина αs1-I пептид, но этот пептид далее расщепляет только химозин и энзимы молочнокислых бактерий.
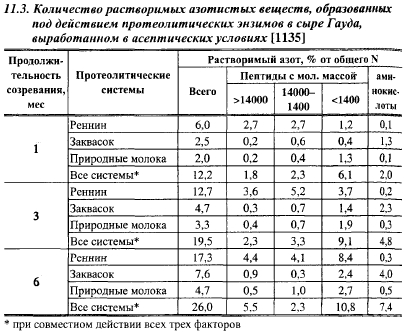
В сырах, вырабатываемых с химозином, последний ответственен за образование значительной части растворимого азота, пептидов большой молекулярной массы, но только небольшой части свободных аминокислот (табл. 11.3). При совместном действии реннина и закваски количество крупных и средних пептидов в сырах уменьшается, а количество мелких пептидов и аминокислот увеличивается, по сравнению с сырами, выработанными без закваски, что свидетельствует об активном расщеплении микрофлорой закваски пептидов, образуемых реннином. Ю. Свириденко и Г. Свириденко объясняют низкую активность молокосвертывающих энзимов при высвобождении свободных аминокислот из казеина стабилизацией пептидных связей связанными с казеином фосфатами.
В протеолизе участвуют не только химозин, но и другие молокосвертывающие энзимы. Пепсины и плесневые протеиназы обладают большей активностью по отношению к æ-, α- и β-казеинам. Продукты расщепления ими казеинов схожи, но не тождественны продуктам, образующимся под воздействием химозина. Исключением является энзим из End. parasitica, сильно отличающийся продуктами протеолиза от других молокосвертывающих энзимов. Чем сильнее молокосвертывающие энзимы отличаются от химозина, тем больше вероятность возникновения пороков.
Гидролиз α- и β-казеинов молокосвертывающими энзимами идет с гораздо более низкой скоростью, чем æ-казеина, но благодаря длительности созревания и участию протеолитических энзимов микрофлоры закваски к концу созревания αs1-казеин и часть β-казеина бывают расщеплены. Пептиды, получающиеся в результате гидролиза казеинов молокосвертывающими энзимами, более доступны, чем исходный казеин, для протеолитических энзимов микрофлоры заквасок, которые играют главную роль в созревании твердых сыров.
- Молокосвертывающие энзимы (часть 1)
- Энзимы микрофлоры сырого молока (часть 3)
- Энзимы микрофлоры сырого молока (часть 2)
- Энзимы микрофлоры сырого молока (часть 1)
- Природные энзимы молока для твердых сыров (часть 3)
- Природные энзимы молока для твердых сыров (часть 2)
- Природные энзимы молока для твердых сыров (часть 1)
- Общие положения формирования твердых сыров (часть 7)
- Общие положения формирования твердых сыров (часть 6)
- Общие положения формирования твердых сыров (часть 5)
- Общие положения формирования твердых сыров (часть 4)
- Общие положения формирования твердых сыров (часть 3)
- Общие положения формирования твердых сыров (часть 2)
- Общие положения формирования твердых сыров (часть 1)
- Влияние соли на показатели (часть 2)
- Влияние соли на показатели (часть 1)
- Рассол для посолки сыров
- Абсорбция соли сыром (часть 4)
- Абсорбция соли сыром (часть 3)
- Абсорбция соли сыром (часть 2)
- Абсорбция соли сыром (часть 1)
- Посолка сухой солью и инъекционными способами
- Частичная посолка в зерне
- Посолка в рассоле (часть 3)
- Посолка в рассоле (часть 2)
- Посолка в рассоле (часть 1)
- Полная посолка в зерне (часть 3)
- Полная посолка в зерне (часть 2)
- Полная посолка в зерне (часть 1)
- Посолка молока
