Свойства молокосвертывающих энзимов (часть 5)
Гидролиз α- и β-казеинов идет с гораздо более низкой скоростью, чем æ-казеина, но благодаря длительности созревания и участия протеолитических энзимов микрофлоры закваски к концу созревания (αs1-казеин и часть β-казеина бывают расщеплены. Пептиды, получающиеся в результате гидролиза казеинов молокосвертывающими энзимами, более доступны, чем исходный казеин, для протеолитических энзимов молочнокислой микрофлоры, которые играют главную роль в созревании твердых сыров. Участие в созревании, т. е. в формировании характерных для сыров органолептических показателей, - вторая функция молокосвертывающих энзимов в сыроделии.
Из молокосвертывающих энзимов по общей протеолитической активности ближе всего к химозину стоит говяжий пепсин, свиной пепсин обладает более высокой общей протеолитической активностью; наименее пригоден для сыроделия куриный пепсин. Однако по другим данным, белый рассольный сыр, выработанный с цыплячьим пепсином или его смесью с реннетом, ничем не отличались от контрольных, выработанных только с реннетом, кроме более высокого содержания сухих веществ и общего азота.
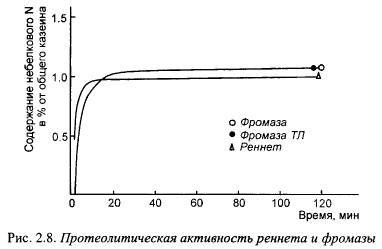
Плесневые протеазы по общей протеолитической активности отличаются от химозина и говяжьего пепсина, что отрицательно влияет на консистенцию сыров, вырабатываемых с их участием, оставляя ее приемлемой для потребителя. Сравнение протеолитической активности фромазы и сычужного порошка показано на рис. 2.8 (по материалам фирмы «Гист-Брокадес»), Количественные различия в протеолитической активности, оцениваемой по отношению небелкового азота к общему содержанию азота казеина, между реннетом и фромазой незначительны. Однако даже такие различия могут сказаться на выходе сыра и экономичности применения фромазы; кроме того, они могут отличаться по спектру образуемых продуктов гидролиза.
- Свойства молокосвертывающих энзимов (часть 4)
- Свойства молокосвертывающих энзимов (часть 3)
- Свойства молокосвертывающих энзимов (часть 2)
- Свойства молокосвертывающих энзимов (часть 1)
- Основные понятия молокосвертывающих энзимов (часть 2)
- Основные понятия молокосвертывающих энзимов (часть 1)
- Мицеллы казеина (часть 7)
- Мицеллы казеина (часть 6)
- Мицеллы казеина (часть 5)
- Мицеллы казеина (часть 4)
- Мицеллы казеина (часть 3)
- Мицеллы казеина (часть 2)
- Мицеллы казеина (часть 1)
- Белки молока (часть 2)
- Белки молока (часть 1)
- Общие понятия коагуляции молока (часть 2)
- Общие понятия коагуляции молока (часть 1)
- Классификация сыров (часть 7)
- Классификация сыров (часть 6)
- Классификация сыров (часть 5)
- Классификация сыров (часть 4)
- Классификация сыров (часть 3)
- Классификация сыров (часть 2)
- Классификация сыров (часть 1)
- Развитие сыроделия в России (часть 8)
- Развитие сыроделия в России (часть 7)
- Развитие сыроделия в России (часть 6)
- Развитие сыроделия в России (часть 5)
- Развитие сыроделия в России (часть 4)
- Развитие сыроделия в России (часть 3)
