Свойства молокосвертывающих энзимов (часть 7)
Оптимальный pH для общей протеолитической активности при прочих одинаковых условиях равняется для пепсинов 2, для гастриксина - примерно 3, химозина - 3-4, плесневых протеиназ - 3-4. Эти значения существенно отличаются от интервалов pH, характерных для производства сыров, что в определенной степени снижает отрицательное влияние на качество сыров повышенной, по сравнению с химозином, общей протеолитической активности кислых протеиназ, применяемых в сыроделии.
Стабильность молокосвертывающих энзимов зависит от ионной силы среды, температуры, продолжительности выдержки и концентрации энзимов. Пепсин и химозин автолизируются при величине pH, оптимальной для их общей протеолитической активности. Плесневые протеиназы стабильны при pH до 2,5.
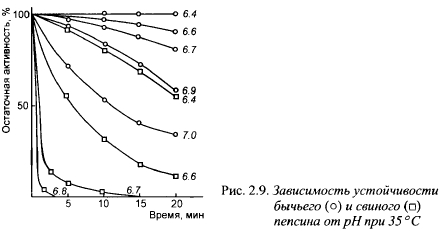
Общим свойством молокосвертывающих энзимов является снижение общей протеолитической активности при pH среды выше оптимального уровня. Одной из причин этого является инактивация энзимов при высоком pH. Скорость инактивации зависит от вида энзима (рис. 2.9). Так, говяжий пепсин начинает инактивироваться после 20-минутной выдержки только при pH выше 6,4, а при pH 7,0 сохраняет более трети исходной активности. В то же время свиной пепсин после 20-минутной выдержки при pH 6,4 теряет свыше 50% исходной активности, а при pH 7,0 почти моментально полностью инактивируется. Для свертывания молока с pH 6,6 за 5 мин, требуется одинаковая масса говяжьего и свиного пепсина, а при свертывании за 20 мин, свиного пепсина требуется в 2,5 раза больше, чем говяжьего. Быстрая инактивация свиного пепсина в слабокислой среде, какой является молоко, является главным недостатком его как молокосвертывающего энзима.
- Свойства молокосвертывающих энзимов (часть 6)
- Свойства молокосвертывающих энзимов (часть 5)
- Свойства молокосвертывающих энзимов (часть 4)
- Свойства молокосвертывающих энзимов (часть 3)
- Свойства молокосвертывающих энзимов (часть 2)
- Свойства молокосвертывающих энзимов (часть 1)
- Основные понятия молокосвертывающих энзимов (часть 2)
- Основные понятия молокосвертывающих энзимов (часть 1)
- Мицеллы казеина (часть 7)
- Мицеллы казеина (часть 6)
- Мицеллы казеина (часть 5)
- Мицеллы казеина (часть 4)
- Мицеллы казеина (часть 3)
- Мицеллы казеина (часть 2)
- Мицеллы казеина (часть 1)
- Белки молока (часть 2)
- Белки молока (часть 1)
- Общие понятия коагуляции молока (часть 2)
- Общие понятия коагуляции молока (часть 1)
- Классификация сыров (часть 7)
- Классификация сыров (часть 6)
- Классификация сыров (часть 5)
- Классификация сыров (часть 4)
- Классификация сыров (часть 3)
- Классификация сыров (часть 2)
- Классификация сыров (часть 1)
- Развитие сыроделия в России (часть 8)
- Развитие сыроделия в России (часть 7)
- Развитие сыроделия в России (часть 6)
- Развитие сыроделия в России (часть 5)
