Протеолитические энзимы заквасок (часть 7)
Представляет интерес влияние молокосвертывающих энзимов на протеолитическую активность лактококков. В табл. 11.5 представлены результаты опытов Вязниковой и др. по изучению влияния молокосвертывающих энзимов на протеолитическую активность Lc. lactis в обезжиренном молоке (время инкубации 10 сут, температура 30° С). Из этих данных видно, что в культурах лактококка в присутствии пепсинов, по сравнению с их культурами в молоке без добавления энзимов, произошло снижение количества водорастворимого азота на 50,2-45,2% и свободных кислот на 53,4-63,8%, а количество небелкового азота возросло на 20,2-42,4%, в то время как в присутствии реннета увеличилось содержание всех фракций: водорастворимого азота - на 21, небелкового азота - на 13,9 и аминного - на 104,8%. В варианте с реннетом увеличение количества водорастворимого и небелкового азота произошло в результате энзиматической реакции, а увеличение содержания аминного азота является результатом резкого повышения протеолитической активности лактококка в присутствии реннета. Пепсины в условиях опыта, по-видимому, не проявили или проявили незначительную казеолитическую активность, а снижение содержания аминного азота говорит об использовании культурой низкомолекулярных пептидов и аминокислот для синтеза собственных белков.
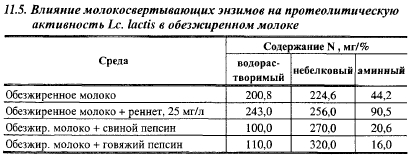
Сычужный порошок по-разному влияет на протеолитическую активность различных подвидов лактококков. Лактококки атакуют параказеин и в отсутствие молокосвертывающих энзимов, даже после гибели клеток, что свидетельствует об участии в этом процессе эндоферментов.
Таким образом, лактобактерии обладают достаточной протеолитической активностью для расщепления совместно с реннином казеинов до свободных аминокислот. Специфичность действия их протеолитических систем зависит от вида и штамма и значительно варьирует.
Лактобактерии обладают фосфомоноэстеразной активностью, которая является штаммовым признаком. Этот тип энзиматической активности может иметь значение при расщеплении фосфопептидов, образующихся в сырах в процессе протеолиза и, возможно, причастных к образованию горечи. Роль фосфомоноэстераз лактобактерий в сырах не изучена.
- Протеолитические энзимы заквасок (часть 6)
- Протеолитические энзимы заквасок (часть 5)
- Протеолитические энзимы заквасок (часть 4)
- Протеолитические энзимы заквасок (часть 3)
- Протеолитические энзимы заквасок (часть 2)
- Протеолитические энзимы заквасок (часть 1)
- Общие понятия энзимов микрофлоры заквасок
- Молокосвертывающие энзимы (часть 4)
- Молокосвертывающие энзимы (часть 3)
- Молокосвертывающие энзимы (часть 2)
- Молокосвертывающие энзимы (часть 1)
- Энзимы микрофлоры сырого молока (часть 3)
- Энзимы микрофлоры сырого молока (часть 2)
- Энзимы микрофлоры сырого молока (часть 1)
- Природные энзимы молока для твердых сыров (часть 3)
- Природные энзимы молока для твердых сыров (часть 2)
- Природные энзимы молока для твердых сыров (часть 1)
- Общие положения формирования твердых сыров (часть 7)
- Общие положения формирования твердых сыров (часть 6)
- Общие положения формирования твердых сыров (часть 5)
- Общие положения формирования твердых сыров (часть 4)
- Общие положения формирования твердых сыров (часть 3)
- Общие положения формирования твердых сыров (часть 2)
- Общие положения формирования твердых сыров (часть 1)
- Влияние соли на показатели (часть 2)
- Влияние соли на показатели (часть 1)
- Рассол для посолки сыров
- Абсорбция соли сыром (часть 4)
- Абсорбция соли сыром (часть 3)
- Абсорбция соли сыром (часть 2)
