Свойства молокосвертывающих энзимов (часть 8)
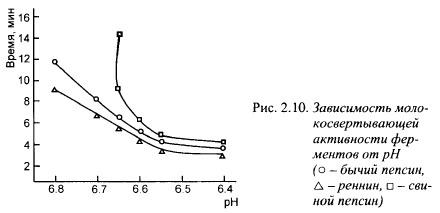
Оптимальный pH для гидролиза æ-казеина химозином равен примерно 6,0, однако в интервале pH от 5,6 до 6,4 разница в скорости реакции невелика; активность снижается при pH выше 6,5 с несколько меньшей скоростью, чем для говяжьего пепсина (рис. 2.10). В интервале pH 6,6-6,7, характерном для молока в начале выработки сыра, скорость гидролиза æ-казеина химозином остается достаточно высокой. Куриный пепсин, гастриксин, фромаза стабильны в диапазоне pH, характерном для выработки и созревания сыра.
Молокосвертывающие энзимы различаются по отношению к температуре. Изменение молокосвертывающей активности фромазы и сычужного порошка в зависимости от температуры показано на рис. 2.11 (по материалам фирмы «Гист-Брокадес»). Отношение к температуре говяжьего пепсина почти такое же, как у сычужного порошка. В порядке возрастания устойчивости к нагреванию молокосвертывающие энзимы располагаются следующим образом: свиной пепсин, говяжий пепсин, химозин, фромаза и М. pusillus протеазы.
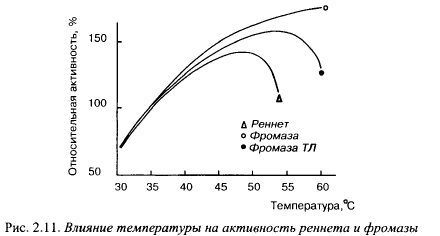
Устойчивость к нагреванию понижается при повышении pH. Молокосвертывающая активность сычужного порошка максимальна при 45° С, чистого пепсина - при 35° С.
Желудочные протеазы млекопитающих показывают различную чувствительность к мочевине: пепсин к ней устойчив, химозин нет. Эти различия используют для их идентификации.
Обработка молока для выработки сыра 0,01-0,15% перекиси водорода повышает активность молокосвертывающих энзимов и микрофлоры закваски, увеличение дозы перекиси до 0,03-0,15% оказывает ингибирующее действие.
- Свойства молокосвертывающих энзимов (часть 7)
- Свойства молокосвертывающих энзимов (часть 6)
- Свойства молокосвертывающих энзимов (часть 5)
- Свойства молокосвертывающих энзимов (часть 4)
- Свойства молокосвертывающих энзимов (часть 3)
- Свойства молокосвертывающих энзимов (часть 2)
- Свойства молокосвертывающих энзимов (часть 1)
- Основные понятия молокосвертывающих энзимов (часть 2)
- Основные понятия молокосвертывающих энзимов (часть 1)
- Мицеллы казеина (часть 7)
- Мицеллы казеина (часть 6)
- Мицеллы казеина (часть 5)
- Мицеллы казеина (часть 4)
- Мицеллы казеина (часть 3)
- Мицеллы казеина (часть 2)
- Мицеллы казеина (часть 1)
- Белки молока (часть 2)
- Белки молока (часть 1)
- Общие понятия коагуляции молока (часть 2)
- Общие понятия коагуляции молока (часть 1)
- Классификация сыров (часть 7)
- Классификация сыров (часть 6)
- Классификация сыров (часть 5)
- Классификация сыров (часть 4)
- Классификация сыров (часть 3)
- Классификация сыров (часть 2)
- Классификация сыров (часть 1)
- Развитие сыроделия в России (часть 8)
- Развитие сыроделия в России (часть 7)
- Развитие сыроделия в России (часть 6)
