Гидролиз сывороточных белков
Сывороточные белки обладают ценнейшими биологическими свойствами, они содержат оптимальный набор жизненно необходимых аминокислот и с точки зрения физиологии питания приближаются к аминокислотной шкале «идеального» белка. Необходимо принять во внимание, что в настоящее время широкое распространение получила пищевая аллергия и непереносимость белков пищи. По данным ВОЗ, пищевой аллергией страдают в настоящее время во всем мире не менее 1-2% взрослых и не менее 5% детей. В лечении пищевой аллергии центральное место по-прежнему занимает элиминационный принцип, состоящий в удалении аллергенного продукта из диеты больного. В то же время элиминируемые высокоаллергенные продукты обладают высокой пищевой ценностью, являясь источниками полноценного белка и ряда микронутриентов. В этой связи актуальность приобретает проблема создания специализированных гипоаллергенных продуктов, содержащих источник полноценного белка, не вызывающего аллергических реакций. Для этого необходимо, чтобы в составе белкового компонента продукта отсутствовали структуры, способные при поступлении с пищей вызывать аллергические реакции.
Как известно, детерминанты, распознаваемые иммунокомпетентными клетками и антителами в белках, могут быть нескольких типов. Это «последовательные» эпитопы, представляющие собой короткие (несколько остатков) фрагменты пептидной цепи; «петлевые» эпитопы, являющиеся также короткими фрагментами, но жестко стабилизированными дисульфидными мостиками; «конформационные» эпитопы, образованные пространственно сближенными в молекуле белка аминокислотными остатками, принадлежащими к удаленным друг от друга участками последовательности.
Если структуры 3-го типа достаточно эффективно разрушаются даже при относительно неглубоком ферментативном гидролиза белка, то детерминанты 1-го и 2-го типа могут сохраняться даже в сравнительно коротких пептидах, состоящих из 10-20 аминокислотных остатков. При этом для ряда пищевых аллергенов, в частности, β-лактоглобулина коровьего молока, аллергенные детерминанты являются именно «последовательными» эпитопами.
Свободные аминокислоты и короткие фрагменты пищевых белков, образующиеся при протеолизе, не аллергенны, хотя последние и могут содержать отдельные аллергенные эпитопы.
Гидролиз сывороточных белков актуален по нескольким причинам. Во-первых, смеси пептидов различной длины всасываются в пищеварительном тракте быстрее и полнее, чем эквивалентные по составу смеси аминокислот. Во-вторых, в составе белковых гидролизатов могут присутствовать различные физиологически активные пептиды, необходимые для регуляции ряда важных функций организма. В-третьих, возможно положительное влияние пептидов, на усвоение некоторых эссенциальных микронутриентов, а именно ионов металлов. В составе ферментативных гидролизатов казеина и белка молочной сыворотки присутствуют пептиды, способные образовывать прочные координационные (хелатные) соединения с ионами кальция и значительно усиливать эффективность их всасывания. В-четвертых, ферментативные гидролизаты белка в составе специализированных гипоаллергенных продуктов имеют определенные технологические (функциональные) преимущества над смесями аминокислот.
Гидролиз сывороточных белков может быть осуществлен химическим (под действием минеральных кислот и щелочей при повышенных температурах) и ферментативным (с использованием препаратов протеолитических ферментов) способами. В ходе кислотного гидролиза расщепляются все типы пептидных связей между различными аминокислотными остатками, и поэтому возможно практически полное расщепление белка. Однако кислотный гидролиз как технологический процесс имеет ряд недостатков (частичное или полное разложение ряда аминокислот, образование меланоидинов, необходимость нейтрализации кислоты).
При щелочном гидролизе белка происходит рацемизация аминокислот, в результате чего получающийся гидролизат утрачивает биологическую ценность. В пищевых производствах щелочной гидролиз белка не применяется. Существующие методики получения щелочных гидролизатов белков направлены в основном на получение препаратов технического (не пищевого) назначения.
Преимуществом ферментативного гидролиза белка является, в первую очередь то, что этот процесс идет с высокой скоростью при относительно мягких условиях: атмосферном давлении и температуре не выше 70 °С (как правило, 37-50 °С), поэтому он практически не сопровождается повреждением аминокислот и снижением биологической ценности. Основными продуктами ферментативного гидролиза практически всегда являются пептиды, а фракция свободных аминокислот, как правило, относительно невелика.
Среди веществ, способствующих ферментативной модификации пищевых белков, существенное место занимают протеолитические ферментные препараты различного происхождения, под влиянием которых в белковой молекуле происходит специфическое расщепление пептидных связей, в результате изменяется молекулярная масса белка, растет его гидрофобность и усваиваемость организмом.
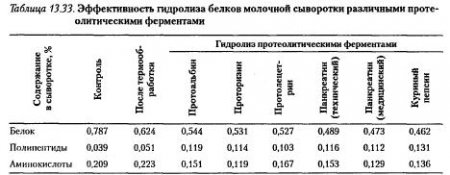
Наиболее широким и перспективным источником лротеиназ являются микроорганизмы, относящиеся к родам Bacillus, Aspergillus, Penxcillium, Streptomyces, Pseudomonas. Протеиназы животного происхождения, как и микробиологические препараты, имеют перспективы для их использования в гидролизе белков молочной сыворотки. Эффективность гидролиза белков молочной сыворотки различными протеолитическими ферментами приведена в табл. 13.33.
По эффективности гидролиза белков молочной сыворотки протеолитические ферменты можно расположить в следующий ряд ( % гидролиза):

Биологически полноценные гидролизаты молочного белка получают путем применения комбинаций протеаз животного происхождения и препаратов микробного синтеза, в частности панкреатина и протосубтилина. В зависимости от применяемых ферментных препаратов или различных их комбинаций с помощью регулирования их температурных режимов гидролиза и его продолжительности можно получить ферментативные препараты сывороточных белков различного функционального назначения.
На кафедре прикладной биотехнологии Северо-Кавказского государственного технического университета аспирантом Н.С. Донским и докторантом А.Д. Лодыгиным проведены экспериментальные исследования ферментативного гидролиза сывороточных белков. Объектом исследований являлся сывороточный концентрат (ретентант) полученный методом ультрафильтрации. Ниже информационно приводятся некоторые результаты промежуточных исследований. В системном виде работа близка к завершению.
Важным фактором для эффективного проведения ферментативного гидролиза сывороточных белков, является pH среды. Существуют химические способы раскисления молочной сыворотки. Однако химические реактивы приводят к необратимым изменениям компонентов молочной сыворотки и отрицательно влияют на выход продуктов гидролиза, как сывороточных белков, так и лактозы. Наибольший интерес вызывает способ электрохимической активации.
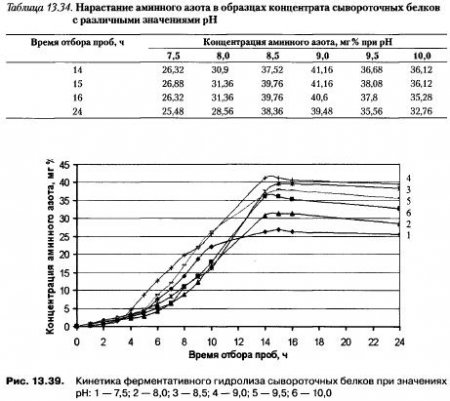
Для проведения гидролиза белков молочной сыворотки в ультраконцентрате, подвергнутом электроактивационной обработке до оптимальных значений pH, использован панкреатин ПЗх. Степень гидролиза оценивали по нарастанию аминного азота в исследуемых образцах по сравнению с контролем — исходным концентратом сывороточных белков (табл. 13.34).
Кинетика ферментативного гидролиза сывороточных белков представлена на рис. 13.39.
Установлено, что электроактивация положительно влияет на процесс протеолиза сывороточных белков: снижается продолжительность ферментации, необходимая для достижения максимального значения степени протеолиза, до 14-15 ч; сокращается расход ферментного препарата; исключается использование щелочных регентов для установления оптимальных для действия панкреатина значений pH субстрата.
Технологический процесс ферментативного гидролиза сывороточных белков в концентратах, подвернутых электрохимической активации, представляется перспективным применительно к технологии следующих групп продуктов:
— концентраты сывороточных белков, получаемые методами ультра- и диафильтрации с регулируемым уровнем протеолиза;
— комплексные препараты с регулируемым углеводным и минеральным составом на основе композиций гидролизатов сывороточных белков и лактозы (гликопротеомика);
— бифидогенные концентраты лактулозы синергетического действия, обогащенные гидролизатами сывороточных белков (гликопротеомика).
Особый интерес при изучении проблемы гидролиза сывороточных белков имеет направленное и управляемое регулирование аминокислотного состава получаемых продуктов. В практическом плане — это прежде всего помощь страждущим детям с фенилкетонурией. Фенилкетонурия — наследственное заболевание, связанное с нарушением аминокислотного обмена. Она является наиболее распространенным заболеванием по сравнению с другими наследственными нарушениями аминокислотного обмена. До настоящего времени единственным эффективным методом лечения данного заболевания является диетотерапия.
Проблема имеет глобальное значение и на мировом уровне решена — известна целая серия продуктов. В нашей стране к ее решению было привлечено внимание ИП АМН. Много раз к ней возвращался проф. П.Ф. Крашенинин с сотр. НИИДП. В системном виде проблему рассмотрел В.И. Круглик. Практический вклад в ее решение внесла школа проф. Л.А. Остроумова (КемТИИПП) — работа АЛО. Просекова с сотр. Системные исследования проведены в Сибирском институте сыроделия В. В. Ельчаниновым с сотр. Кратко остановимся на сути разработок, для подчеркивания уровня проблематики и оригинальности подходов к ее решению.
Используемые в настоящее время технологии при производстве гидролизатов белка с низким содержанием фенилаланина основаны на селективной адсорбции или мембранном фракционировании частичных гидролизатов белка. Получаемые препараты не оказывают эффективного воздействия на коррекцию патологического состояния больного, поскольку расщепление полипептидной цепи молекулы белка ведут протеазами. При этом степень гидролиза достигает 30-60%, что не обеспечивает достаточно полного удаления фенилаланина из полипептидной цепи.
В связи с этим, необходимо разрабатывать новые подходы к получению таких продуктов, которые будут обеспечивать достаточно полное удаление фенилаланина из реакционной смеси при высоком выходе продукта. С этой целью может быть использована фенилаланин-аммонийлиаза, являющаяся ключевым ферментом метаболизма фенилпроаноидов в растениях и грибах. Данный фермент участвует в синтезе вторичных метаболитов (флавоноидов, фуранокумаринов, компонентов клеточных стенок) и существует в виде множественных изоформ. Фенилаланин-аммонийлиаза характеризуется наибольшей специфичностью по отношению к фенилаланину по сравнению с другими ферментами его метаболизма в растениях.
Установлены оптимальные параметры биотрансформации фенилаланина под действием препарата фенилаланин-аммонийлиазы: температура 30 °С, pH 8,5 (буфер трис-HCl), продолжительность ферментации 4 ч, соотношение фермента с субстратом 1:50. Разработанная технология обеспечивает получение энзиматических белковых гидролизатов с заданным аминокислотным составом при максимальном удалении фенилаланина из полипептидной цепи, что позволяет рекомендовать их для использования в продуктах питания для больных фенилкетонурией.
Реализован комплекс исследований по разработке технологии получения смеси аминокислот из белков молочной сыворотки с применением методов промышленной хроматографии. Основой технологии является кислотный гидролиз белков в (14-18)%-м растворе соляной кислоты при температуре (115-120) °С и давлении 1,5 атм. в течение не более 20 ч (до прекращения нарастания аминного азота). Для получения смеси аминокислот рекомендовано использовать молочное сырье с массовой долей белка не менее 30%. Для глубокого фракционирования близких по физико-химическим свойствам аминокислот предложен метод группового разделения гидролизатов с использованием катионитов, анионитов, амберлита и активированных углей. Разработанный способ позволяет получать концентраты основных (аргинин, гистидин, лизин) и нейтральных (цистин, глицин, серин, треонин, аланин, пролин, метионин, валин, лейцин, изолейцин) аминокислот с отделением фракции дикарбоновых аминокислот (глутаминовая, аспарагиновая).
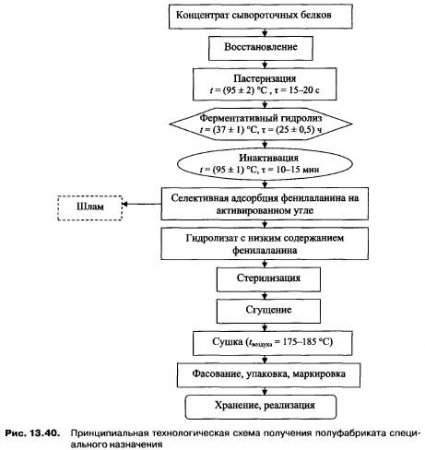
В работе изучен аминокислотный состав молочных продуктов с высоким содержанием фенилаланина и потенциально пригодных для приготовления детских молочных продуктов для больных фенилкетонурией. Установлено, что наиболее рациональным сырьем в технологии продуктов для больных фенилкетонурией является сухая молочная сыворотка, содержащая полный набор аминокислот в оптимальном для организма ребенка соотношении при минимальной концентрации фенилаланина в пересчете на белок. Определены рациональные параметры проведения гидролиза белков молока под действием энзимотрической системы «химотрипсин — карбоксипептидаза А — лейцинаминопептидаза»: температура (37 ± 1) °С, концентрация ферментов 0,01 % от массы белка, продолжительность (25 ± 0,5) ч. По результатам исследований разработана технология получения полуфабриката специального назначения, представленная в виде принципиальной схемы на рис. 13.40.
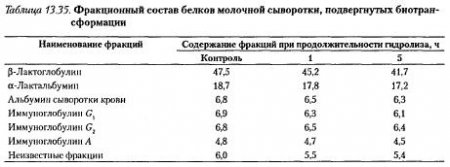
Работа по данному направлению продолжена в КемТИПП с разработкой технологии новых композиционных продуктов молочного типа, основанной на биотрансформации сывороточных белков. В качестве объекта при проведении экспериментальных исследований использован раствор КСБ, подвергнутый энзиматической модификации 0,1%-м раствором пепсина. Сравнительный фракционный состав белков молочной сыворотки до и после ферментативной модификации приведен в табл. 13.35.
По результатам исследований ферментативная обработка концентрата сывороточных белков, позволяющая провести корректировку их количественного и качественного состава, рекомендована в качестве обязательного элемента технологического процесса при их использовании в продуктах питания специального назначения.
Специалистами Сибирского НИИ сыроделия в рамках разработки продуктов питания для больных фенилкетонурией изучены аминокислотные последовательности фракций αs1-, αs2-, β-, к-казеинов. Установлено, что относительное содержание фенилаланина составляет по фракциям казеина: αs1 - 4,02 %, αs2 - 2,90 %, β - 4,31 %, к - 2,37 %. Результаты исследований свидетельствуют о том, что невысокое относительное содержание фенилаланина, реоморфная (открытая) третичная структура, низкое содержание трудногидролизуемых аминокислотных последовательностей позволяет использовать казенны молока для получения белковых гидролизатов — компонентов питания больных фенилкетонурией.
Аналогичные исследования проведены применительно к основным фракциям белков молочной сыворотки, для которых содержание фенилаланина составляет: β-лактоглобулин — 2,47 %, α-лактальбумин — 3,25 %, альбумин сыворотки крови — 4,63 %, лактоферрин — 3,92 %. Применение сывороточных белков в качестве сырья для получения продуктов специального назначения ограничивается высоким содержанием дисульфидных связей.
Степень ферментативного гидролиза определяется физическим состоянием субстрата. Нативные белки, насыщенные сульфгидрильными связями, характеризуются ограниченным протеолизом. Для более полного гидролиза требуется денатурация белка с обязательным восстановлением дисульфидных связей, что достигается применением специфических денатурирующих агентов (8 M мочевина, 6 M гуанидин-хлорид) с последующим алкилированием образующихся остатков цистеина. Анализ первичной структуры сывороточных белков показывает, что большинство из них содержит большое количество (от 4 до 17) внутримолекулярных дисульфидных связей, что затрудняет получение белковых гидролизатов с пониженным содержанием фенилаланина.
Следует обратить внимание, что проблема направленного и управляемого протеолиза белков молока в целом и сывороточных белков в частности только поставлена. Ее решение, например, получение биоактивных пептидов — иммунопептидов, казоморфинов, казокининов, иммуноглобулинов, лактоферрина, казеинфосфопептидов, лактофинов и др., упомянутое в свое время А. Тепелом, а так же линейки аминокислот, само по себе имеет глобальное значение.
- Биотрансформация лактозы и лактулозы в модифицированных питательных средах
- Биотехнологическая обработка бесказеиновой фазы
- Влияние лактулозы на биохимические свойства микрофлоры в кисломолочных продуктах
- Влияние заквасочной микрофлоры на содержание лактулозы в различных кисломолочных продуктах
- Культивирование лактозоусваивающих дрожжей в технологии лактулозы
- Биотрансформация лактозы и ее производных микроорганизмами
- Изучение процесса изомеризации лактозы в лактулозу в присутствии небелкового азота
- Специфика изомеризации лактозы в лактулозу в концентратах молочной сыворотки
- Изомеризация лактозы в лактулозу на ионитах
- Синтез лактулозы с гуанидином в ультрафильтратах молочной сыворотки
- Современные способы синтеза лактулозы
- Ферментативный гидролиз лактозы в ультрафильтратах (пермеатах) молочной сыворотки
- Параметры гидролиза лактозы в молочной сыворотке ферментным препаратом Ha-Lactase
- Особенности гидролиза лактозы в молочной сыворотке
- Общие положения о биотрансформации компонентов молочной сыворотки
- Особенности процесса гранулирования сывороткосодержащих композиций
- Исследование структурно-механических свойств сыворотки и сывороткосодержащих композиций
- Выбор способа гранулирования и особенности формирования гранул молочной сыворотки
- Молочная сыворотка как объект гранулирования
- Теоретические основы гранулирования с окатыванием
- Денатурация как этап микропартикуляции сывороточных белков
- Получение заменителей жира на основе денатурированных белков молочной сыворотки
- Общие положения о микропартикуляции белков молочной сыворотки
- Токсикологическая оценка пищевых добавок из эхинацеи пурпурной в сочетании с молочной сывороткой
- Химический состав и биологическая активность пищевой добавки из эхинацеи пурпурной
- Исследование процесса экстракции эхинацеи пурпурной
- Технология комплексного препарата из молочной сыворотки и экстрактов лекарственных растений
- Модификация молочной сыворотки солодкой голой с использованием ЭХА-воды и хитозана
- Модификация молочной сыворотки препаратами стевии
- Классификация гелей на основе молочной сыворотки