Биотрансформация лактозы и лактулозы в модифицированных питательных средах
А.С. Бессоновым совместно с доц. А.Д. Лодыгиным разработана технология синбиотического концентрата на основе молочной сыворотки с лактозой, частично изомеризованной в лактулозу с использованием анионообменных смол. Теоретической основой технологии является процесс ферментации модифицированных лактозосодержащих сред культурами бифидобактерий.
Обоснование состава среды для культивирования бифидобактерий. В нашей стране и за рубежом проведены многочисленные исследования по подбору ростовых и питательных сред, рекомендованных для выделения и культивирования бифидобактерий. При этом в качестве ингредиентов чаще всего используются томатный сок, экстракт мяса, печени и т.д. Почти во всех субстратах используются разнообразные пептоны. Для приготовления сред также используют альбумин, казеин, дрожжевые автолизаты, отвары печени рыбы, экстракты злаковых растений.
Молочная сыворотка является весьма перспективной средой для развития бифидобактерий. Особый интерес представляет изомеризованная сыворотка. Традиционные лактозосодержащие питательные среды для культивирования бифидобактерий, кроме лактозы, содержат источники азотного питания, как правило, белковые гидролизаты (пептон, лактопептон, гидролизованное обезжиренное молоко и т.д.), источники минерального питания, различные стимуляторы роста (кукурузный экстракт, дрожжевой автолизат и т.д.). Анаэробные условия в среде создаются путем внесения цистеина, а также агара или желатина, затрудняющих диффузию кислорода воздуха в среду.
Для изучения влияния режимов изомеризации лактозы в лактулозу на рост бифидобактерий с помощью анализа литературных источников была разработана модельная питательная среда на лактозо-лактулозной основе следующего состава: молоко обезжиренное гидролизованное — 5 %; NaCl — 0,5%; KH2PO4 — 0,1 %; K2HPO4 — 0,1 %; агар — 0,08%.
В модельной питательной среде часть лактозы заменена на лактулозу, что не оказывает отрицательного воздействия на выход биомассы бифидобактерий, но при этом придает готовому продукту новые полезные свойства.
Исследование влияния процесса изомеризации лактозы в лактулозу на рост бифидобактерий в модельной питательной среде. Для изучения влияния концентрации лактулозы на рост бифидобактерий использовалась модельная питательная среда, лактозо-лактулозная основа которой готовилась из лактозы и сиропа лактулозы. Для приготовления лактозо-лактулозной основы готовили 5 %-й растворы лактозы (марки «ч») и растворы сиропа лактулозы фирмы MILIE (концентрация лактулозы — 83 % от общего содержания углеводов), затем растворы смешивали для получения различной концентрации лактулозы в питательной среде (табл. 13.28). В модельных питательных средах устанавливали pH 7,0-7,2 лимонной кислотой или раствором NaOH, после чего их стерилизовали.
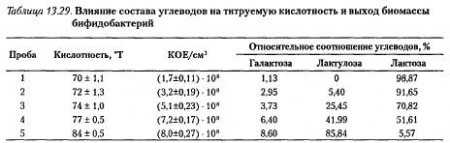
Показатели роста бифидобактерий на среде культивирования определили после 24 часов: кислотность, °T — титриметрическим методом, количество КОЕ — методом предельного разведения и соотношение углеводов — методом газо-жидкостной хроматографии (последний показатель исследовали и в исходной питательной среде). Результаты экспериментов представлены в табл. 13.29.
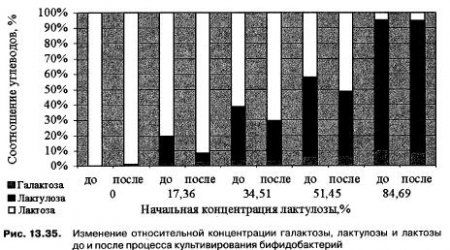
Результаты эксперимента свидетельствуют о том, что внесение сиропа лактулозы в питательную среду стимулирует рост бифидобактерий, то есть способствует увеличению биомассы и нарастанию кислотности. Возможно, это связано с тем, что в питательную среду в составе сиропа вносится не только лактулоза, но и другие углеводы (галактоза и глюкоза), которые легче ферментируются бифидобактериями. Результаты измерения концентраций углеводов свидетельствуют о том, что бифидобактерии в процессе культивирования на питательной среде, содержащей галактозу, лактулозу и лактозу, ферментируют все три углевода (рис. 13.35).
Таким образом, внесение сиропа лактулозы стимулирует рост бифидобактерий и после 24-часового культивирования в питательной среде остаются остаточные концентрации лактулозы.
Для изучения влияния способа изомеризации и процесса ионообменной обработки молочной сыворотки на рост бифидобактерий были использованы следующие варианты основы питательных сред: 1 — осветленная молочная сыворотка; 2 — осветленная сыворотка, подвергнутая изомеризации лактозы в лактулозу раствором Ca(OH)2 (температура изомеризации 80 °С с выдерживанием 25 мин); 3 — осветленная сыворотка, подвергнутая анионообменной обработке, а затем изомеризации при температуре 80 °С в течение 40 мин; 4 — осветленная сыворотка подвергнутая анионообменной обработке.
В модельных питательных средах устанавливали pH 7,0-7,2 лимонной кислотой или раствором NaOH, после чего ее стерилизовали. Количественный учет колоний бифидобактерий (КОЕ/см3) проводили после 24 часов культивирования (табл. 13.30).
Процесс изомеризации лактозы в лактулозу оказывает положительный эффект на рост бифидобактерий. Этот эффект определяется в основном наличием в среде лактулозы и гидролизованных сывороточных белков. При изомеризации с использованием Ca(OH)2 наблюдается больший рост бифидобактерий, чем при использовании безреагентной изомеризации на смоле АВ-17-8 ЧС. Это обусловлено более высокой степенью гидролиза белков, который происходит при использовании в качестве катализатора щелочи. Образец, подвергнутый ионообменной обработке без термостатирования, незначительно превосходит контроль. Это связано с удалением из сыворотки (питательной среды) анионов, негативно влияющих на рост бифидобактерий.
Результаты исследований выявили дефицит белковых веществ в модельных питательных средах, поэтому было изучено влияние дозы внесения гидролизованного обезжиренного молока на рост бифидобактерий. В качестве лактозо-лактулозной основы использовалась осветленная молочная сыворотка, подвергнутая изомеризации безреагентным методом. Концентрация гидролизованного обезжиренного молока составляла 5, 10, 15 и 20% от объема питательной среды (табл. 13.31).
Исходя из полученных результатов, оптимальная концентрация гидролизованного обезжиренного молока составляет 15%, при больших дозах выход биомассы бифидобактерий увеличивается незначительно, что приведет в производственных условиях к возрастанию затрат на приготовление среды при несущественном технологическом эффекте.
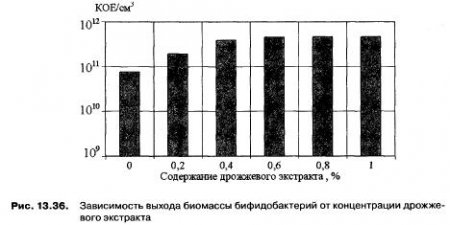
Для дополнительного обогащения питательной среды аминокислотами, а также пуриновыми и пиримидиновыми основаниями, которые являются факторами роста для бифидобактерий, изучено влияние количества дрожжевого экстракта на рост бифидобактерий. Результаты эксперимента представлены на рис. 13.36.
Результаты позволяют сделать вывод о том, что внесение дрожжевого экстракта положительно влияет на рост бифидобактерий, оптимальная концентрация составляет 0,4 %.
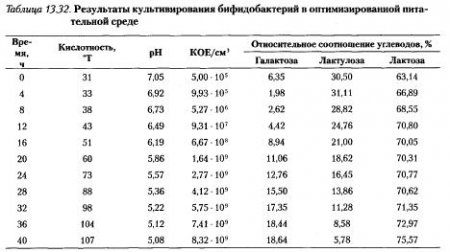
Кинетика роста бифидобактерий в разработанной питательной среде. Изучена кинетика роста бифидобактерий в оптимизированной среде на основе депротеинизироваиной молочной сыворотке, подвергнутой ионному обмену и изомеризации, с добавлением компонентов: молоко обезжиренное гидролизованное — 15 %; NaCl — 0,5 %; KH2PO4 — 0,1 %; K2 HPO4 — 0,1 %; агар — 0,08 %. В полученной питательной среде устанавливали pH 7,0-7,2 лимонной кислотой, после чего ее стерилизовали. Показатели роста бифидобактерий на среде культивирования определяли каждые 4 часа (табл. 13.32).
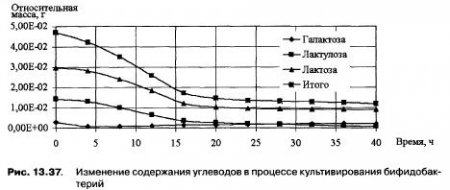
В процессе культивирования происходит нарастание кислотности питательной среды и, следовательно, уменьшение значения pH. В течение всего процесса культивирования (40 часов) происходит увеличение биомассы бифидобактерий, КОЕ достигает 8,0*10в9 в 1 см3. Динамика изменения концентраций углеводов свидетельствует о том, что бифидобактерии в процессе культивирования на питательной среде содержащей галактозу, лактулозу и лактозу ферментируют все три углевода, причем начальная скорость ассимиляции углеводов бифидобактериями в этой последовательности (галактоза, лактулоза и лактоза) уменьшается (рис. 13.37), но она зависит от концентрации субстратов в питательной среде.
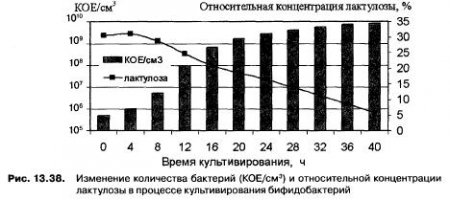
Для определения времени культивирования бифидобактерий проведен сравнительный анализ динамики изменения показателя КОЕ/см3 и относительной концентрации лактулозы в процессе культивирования (рис. 13.38).
Анализ графических зависимостей показывает, что культивирование можно продолжать 16-20 ч. В течение этого времени происходит интенсивное накопление биомассы бифидобактерий и остаточная концентрация лактулозы находится в пределах 18-21% (от общей концентрации углеводов). При продолжении культивирования происходит незначительное увеличение биомассы при стабильном понижении концентрации лактулозы в питательной среде, что не приемлемо для получения синбиотического концентрата. Оптимальная продолжительность культивирования бифидобакетрий для получения синбиотического концентрата составляет (17 ± 1) ч. При этом кислотность питательной среды достигает 53 °Т, pH — 6,11, КОЕ — 7,3*10в88 в 1 см3, а относительная концентрация лактулозы — 20%.
- Биотехнологическая обработка бесказеиновой фазы
- Влияние лактулозы на биохимические свойства микрофлоры в кисломолочных продуктах
- Влияние заквасочной микрофлоры на содержание лактулозы в различных кисломолочных продуктах
- Культивирование лактозоусваивающих дрожжей в технологии лактулозы
- Биотрансформация лактозы и ее производных микроорганизмами
- Изучение процесса изомеризации лактозы в лактулозу в присутствии небелкового азота
- Специфика изомеризации лактозы в лактулозу в концентратах молочной сыворотки
- Изомеризация лактозы в лактулозу на ионитах
- Синтез лактулозы с гуанидином в ультрафильтратах молочной сыворотки
- Современные способы синтеза лактулозы
- Ферментативный гидролиз лактозы в ультрафильтратах (пермеатах) молочной сыворотки
- Параметры гидролиза лактозы в молочной сыворотке ферментным препаратом Ha-Lactase
- Особенности гидролиза лактозы в молочной сыворотке
- Общие положения о биотрансформации компонентов молочной сыворотки
- Особенности процесса гранулирования сывороткосодержащих композиций
- Исследование структурно-механических свойств сыворотки и сывороткосодержащих композиций
- Выбор способа гранулирования и особенности формирования гранул молочной сыворотки
- Молочная сыворотка как объект гранулирования
- Теоретические основы гранулирования с окатыванием
- Денатурация как этап микропартикуляции сывороточных белков
- Получение заменителей жира на основе денатурированных белков молочной сыворотки
- Общие положения о микропартикуляции белков молочной сыворотки
- Токсикологическая оценка пищевых добавок из эхинацеи пурпурной в сочетании с молочной сывороткой
- Химический состав и биологическая активность пищевой добавки из эхинацеи пурпурной
- Исследование процесса экстракции эхинацеи пурпурной
- Технология комплексного препарата из молочной сыворотки и экстрактов лекарственных растений
- Модификация молочной сыворотки солодкой голой с использованием ЭХА-воды и хитозана
- Модификация молочной сыворотки препаратами стевии
- Классификация гелей на основе молочной сыворотки
- Закономерности управления процессом гелеобразования в молочной сыворотке