Микробный пул молочной сыворотки
Микрофлора молочной сыворотки всех видов достаточно разнообразна, что может вызывать порчу сырья и продукции. Методология микробиологических исследований молочной сыворотки аналогична молоку и в достаточной мере проработана в нашей стране Н.С. Королевой, K.А. Банниковой, В.Ф. Семенихиной, А.В. Гудковым, Г.Д. Перфильевым, М.Б. Захаровой, Г. М. Свириденко и др. Специальные исследования по микробному синтезу на молочной сыворотке, с подробной характеристикой исходного объекта, были поставлены М.В. и Л.С. Залашко. В то же время следует отметить, что состав микрофлоры разных видов молочной сыворотки и получаемых из нее продуктов изучен пока недостаточно.
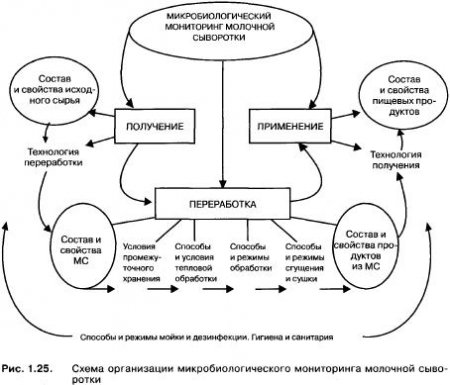
На кафедре прикладной биотехнологии СевКавГТУ аспирантом О.В. Кузнецовой под руководством проф. С.А. Рябцевой была проведена работа по изучению количественного и качественного состава микрофлоры творожной и подсырной сывороток и получаемых из них продуктов. Исследования по микробиологии производных компонентов молочной сыворотки на примере лактулозы были проведены аспиранткой Ю.Г. Гетман, также под руководством проф. С.А. Рябцевой. При этом был разработан и реализован логистический план-схема микробиологического мониторинга вторичного молочного сырья (ВМС), который в интерпретированном виде для молочной сыворотки (MC) приведен на рис. 1.25.
В принципе микробный пул молочной сыворотки любого вида прогнозируем и состоит из остаточной микрофлоры исходного сырья, как правило, после тепловой обработки (пастеризации), вносимых чистых культур заквасочной микрофлоры и микробного пула окружающей среды по всему жизненному циклу сырья, полуфабрикатов и готового продукта.
Источником первичного обсеменения молочной сыворотки микрофлорой является исходное молоко, которое на своем пути от момента зарождения в вымени до потребителя приходит в тесное соприкосновение с целым рядом источников заражения, и чем больше этих источников, тем обильнее и разнообразнее будет первичная микрофлора молока. Эти источники являются неравноценными как по количеству, так и по видовому составу вносимых ими микроорганизмов. Обсеменение молока происходит как на этапе получения, так и в процессе хранения и транспортировки до начала переработки, и зависит от ряда факторов: здоровья животных, санитарного состояния ферм, в том числе плохо вымытого оборудования. При этом микробами, загрязняющими молоко, являются психротрофные микроорганизмы, БГКП, стафилококки, микрококки и коринебактерии, энтерококки, молочнокислые стрептококки, молочнокислые палочки, спорообразующие бактерии. Посторонняя микрофлора может попадать в сырье и из воздуха. В основном воздух является источником обсеменения молока микрококками и спорообразующими бактериями. Тепловая обработка молока-сырья, применяемая практически повсеместно, инактивируя основную массу микроорганизмов, оставляет в нем все их лизаты и т. н. остаточную микрофлору. Вся остаточная микрофлора исходного молока-сырья теоретически может быть представлена в молочной сыворотке.
Вносимые с заквасками чистые культуры микроорганизмов, специфичных для ассортимента белково-жировых продуктов (в основном бактерии, возможно плесени, дрожжи), обеспечивая технологический процесс, в основной массе переходят в молочную сыворотку, «загрязняя» и «обогащая» ее.
Естественно, за исключением стерильного производства белково-жировых продуктов и обработки получаемой молочной сыворотки (пока это только мечта), она обсеменяется посторонней микрофлорой окружающей среды. Посторонняя микрофлора попадает в сыворотку с оборудования и в виде остаточной микрофлоры, оставшейся после пастеризации молока. Это бактерии группы кишечных палочек, молочнокислые и уксуснокислые бактерии, плесневые грибы, дрожжи, а также различные группы споровых микроорганизмов. Среди посторонней микрофлоры творожной сыворотки особую роль играют термоустойчивые молочнокислые палочки, вызывающие порок излишняя кислотность. Развитие бактериофага, повышение температуры технологического процесса и увеличение его продолжительности (процесса сквашивания), а также недостаточно эффективное и быстрое охлаждение, ведет к активному размножению термоустойчивой молочнокислой палочки.
Молочная сыворотка является хорошей питательной средой для развития микроорганизмов, происхождение которых связано как с остаточной термостойкой и термофильной микрофлорой пастеризованного молока, так и с микрофлорой заквасок, используемых при производстве продуктов. К тому же температура и осмоляльность молочной сыворотки идеализированы технологическим регламентом производства белково-жировых продуктов.
По данным М.В. Залашко, среди микрофлоры, остающейся после пастеризации молока и встречающейся в молочной сыворотке, имеются представители как споровой, так и неспоровой групп микроорганизмов. Кроме того, присутствуют виды, не использующие лактозу в качестве источника углеводного питания и энергии. Виды микроорганизмов, характерных для пастеризованного молока и переходящих в сыворотку представлены в табл. 1.37.
B летнем молоке (и в летней молочной сыворотке) термостойких бактерий значительно больше, чем в зимнем. Среди остаточной микрофлоры в сыворотке могут встречаться и психрофильные группы родов Pseudomonas, Achromobactern Flavobacterium. При длительном хранении даже охлажденной сыворотки под воздействием психрофильных бактерий в ней могут развиваться пороки вкуса и запаха (нечистый, гнилостный, фруктовый, прогорклый и др.).
В ходе проведенных исследований было установлено, что на качественный и количественный состав микрофлоры подсырной и творожной сыворотки существенное влияние оказывают следующие факторы: способ получения (для творожной сыворотки), условия хранения и температурные режимы переработки. Кроме того, были выявлены специфические микроорганизмы, присущие жизненному циклу только молочной сыворотки.
Микрофлора подсырной сыворотки. Подавляющее большинство микроорганизмов, присутствующих в молоке или попадающих в подсырную сыворотку из материалов, применяемых при производстве сыра, при контакте молока и компонентов с производственной средой (оборудованием, атмосферой) и работающим персоналом, относятся к посторонней, нерегулируемой микрофлоре. Она способна влиять на свойства микрофлоры подсырной сыворотки на различных этапах получения, переработки и хранения. В микрофлоре подсырной сыворотки могут обнаруживаться БГКП, лактозосбраживающие молочнокислые микроорганизмы, гетероферментативные молочнокислые бактерии, термоустойчивая микрофлора, заквасочные культуры микроорганизмов, дрожжи и плесневые грибы. Основная микрофлора подсырной сыворотки складывается из микрофлоры исходного молока, сычужного фермента и закваски.
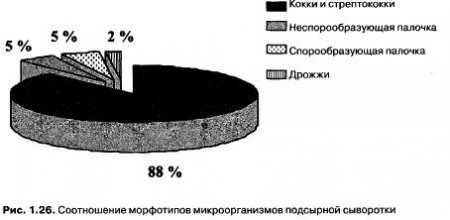
Изучение состава и свойств микрофлоры подсырной сыворотки, полученной при производстве сыра Российский (производитель ОАО «Молочный комбинат «Ставропольский») в промышленных условиях показало следующие результаты: БГКП не обнаружены в 1 см3; КМАФАнМ — (1,3±0,2) * 10в1 КОЕ/см3; дрожжей — 100 200 КОЕ/см3; плесеней — нет. Распределение микробного пула в подсырной сыворотке показано на рис. 1.26.
Микрофлора свежей подсырной сыворотки представлена молочнокислыми микроорганизмами, дрожжами и спорообразующими палочками, кроме того, в ней остается термоустойчивая микрофлора, как кокковой, так и палочковидной формы. Последняя является специфичной и остается на всех стадиях технологического процесса переработки молочной сыворотки. Полученные данные коррелируют с опубликованными ранее.
Исходя из данных по количественному содержанию микроорганизмов, следует, что необходима их инактивация (тепловая обработка, микрофильтрация) для достижения требований, установленных СанПин 2.3.2. 1078-01 «Гигиенические требования к безопасности и пищевой ценности пищевых продуктов» и Федеральным законом № 88 «Технический регламент на молоко и молочную продукцию» для молочной сыворотки.
Для исключения повторного обсеменения сырья с оборудования необходимо особое внимание обратить на процесс мойки и дезинфекции. Так был определен состав остаточной микрофлоры после проведения обычного способа мойки оборудования. В составе остаточной микрофлоры помимо споровых форм остается термоустойчивая неспорообразующая микрофлора палочковидной формы, способная влиять на характеристику сгустка и кислотность основного продукта.
В целом микробный пул натуральной подсырной сыворотки достаточно объемен и разнообразен, что следует учитывать при организации ее промышленной переработки и, особенно, в случае хранения (резервирования).
Микрофлора творожной сыворотки. Количественный состав микрофлоры творожной сыворотки, полученной на механизированной линии Я9-ОПТ-5 и традиционно из ванн, приведен в табл. 1.38.
Установлено, что микробиологическая обсеменность творожной сыворотки зависит от способа ее получения. Сыворотка, полученная при производстве творога на механизированной линии Я9-ОПТ-5, по обсемененности выше на два порядка, чем при производстве творога традиционным способом. На рис. 1.27 приведена характерная картина микрофлоры творожной сыворотки и диаграмма распределения морфотипов.
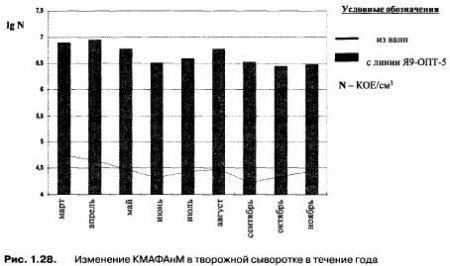
Сезон выработки творога на количественный состав творожной сыворотки влияние не оказывает. На рис. 1.28 показано изменение КМАФАнМ (усредненные данные) в течение года в творожной сыворотке, отобранной из ванны и с механизированной линии Я9-ОПТ-5.
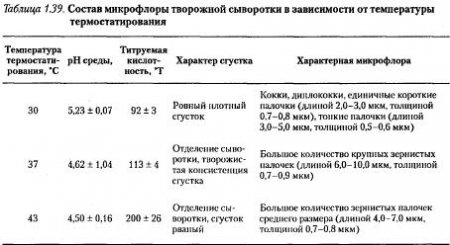
Так, при производстве творога на механизированной линии Я9-ОТП-5 содержание КМАФАнМ в свежей творожной сыворотке в зависимости от месяца выработки составляло (1,4/10) * 10в6 КОЕ/см3, а при производстве в ваннах — (1,5/7,5) * 10в4 КОЕ/см3, количество термофильной микрофлоры соответственно (0,6/9,6) * 10в5 КОЕ/см3 и (0,2/5,5) * 10в3 КОЕ/см3 Качественный состав микрофлоры свежей творожной сыворотки приведен в табл. 1.39.
В составе микрофлоры творожной сыворотки присутствует мезофильная микрофлора заквасок в виде кокков, диплококков и палочковидной формы. Состав микрофлоры в сыворотке, полученной на механизированной линии Я9-ОПТ-5 и из ванн, также не одинаков. Если в сыворотке, полученной из ванн, обнаруживается лишь характерная заквасочная микрофлора (за исключением редких мелких палочек), то в сыворотке, отобранной из обезвоживателя линии Я9-ОПТ-5, обнаруживались термоустойчивые зернистые палочки. Это связано с тем, что в теплообменной системе (TOC) сгусток отваривается и выдерживается при температуре 46-50 °С, а затем охлаждается до 36-40 °С. Рост же термоустойчивой палочки лежит в температурных пределах 45-50 °С. Следовательно, температурные режимы в TOC являются благоприятными условиями для развития термоустойчивых палочек.
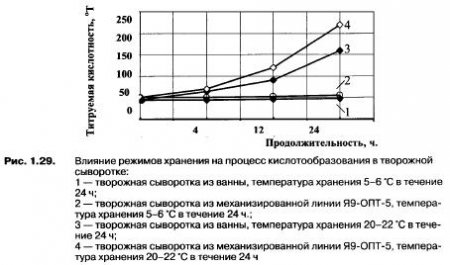
Термоустойчивые палочки, как и факультативно анаэробные споровые палочки, относятся к термофильным микроорганизмам и являются технически вредной микрофлорой, так как вызывают порок перекисания в готовых продуктах. Развитие посторонней технически вредной термоустойчивой микрофлоры на производстве стимулируется повышенными температурами технологического процесса, длительным временем обработки сгустка и недостаточно эффективным и быстром охлаждении. На рис. 1.29 показана зависимость изменения титруемой кислотности творожной сыворотки от условий хранения.
Как показали результаты исследований, при хранении свежей творожной сыворотки в течение 24 ч в охлажденном виде (5-6 °С), титруемая кислотность нарастает незначительно (на 3-4 °Т), но такой режим хранения вызывает появление в сыворотке порока — горький вкус, за счет развития психрофильных микроорганизмов. При хранении свежей творожной сыворотки в течение 24 ч при 20-22 °С, титруемая кислотность уже за 4 ч хранения нарастает на 20-25 °Т, а через сутки составляет 140/160 °Т для творожной сыворотки, полученной из ванн, и 200/220 °Т для творожной сыворотки, полученной из механизированной линии Я9-ОПТ-5.
В процессе резервирования при низких температурах возможно развитие психрофильных микроорганизмов.
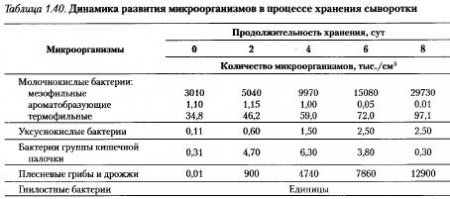
В табл. 1.40 приведена динамика изменения микробного пула творожной сыворотки в течении восьми суток.
Развитие микрофлоры вызывает определенные изменения в составе молочной сыворотки. Общая кислотность ее возрастает более чем в два раза, снижается содержание лактозы, увеличивается количество летучих кислот и происходят незначительные изменения количественных соотношений общего и небелкового азота.
Для более глубокого изучения совместного влияния температуры и времени обработки на обсемененность творожной сыворотки в качестве объекта исследования использовалась наиболее сложная по микробиологическому составу творожная сыворотка, отобранная из механизированной линии Я9-ОПТ-5. Полученные в ходе исследований данные свидетельствуют о том, что наиболее подвержены действию температур бактерии группы кишечной палочки, затем психрофильные микроорганизмы и дрожжи. Термофильные и мезофильные микроорганизмы проявляют большую устойчивость к нагреванию, о чем свидетельствует снижение их количества в сыворотке лишь на три — четыре порядка. Более высокая степень выживания мезофильной микрофлоры (по отношению к термофильной) связана с большим относительным содержанием в ней спорообразующих микроорганизмов, в то время как термофильная микрофлора в основном представлена неспорообразующими палочками.
При хранении творожной сыворотки в охлажденном состоянии количество плесеней и дрожжей резко увеличивается, что может привести к формированию пороков готовой продукции.
Молочнокислая микрофлора, содержащаяся в большом количестве в творожной сыворотке, может влиять на показатели готовой продукции, вырабатываемой на ее основе. Поэтому необходимо учитывать температурные режимы обработки при дальнейшем использовании творожной сыворотки, нельзя допускать движения сыворотки по линиям, предназначенным для движения цельномолочного сырья и готовой продукции.
Сравнивая микробиологическую обсеменность творожной и подсырной сыворотки, можно сделать выводы, что подсырная сыворотка менее обсеменена термоустойчивой микрофлорой и представляет меньшую опасность в качестве источника микрофлоры, вызывающей порок готового продукта. Хотя и в ней сохраняется микрофлора, способная вызывать порок повышенной кислотности. Следовательно, подсырную сыворотку после пастеризации можно направлять на дальнейшую переработку, поскольку нормируемые показатели по БГКП и КМАФАнМ после пастеризации не превышали требуемых норм СанПиН (не более 10в5 КОЕ/см3). Творожная сыворотка, обладающая наиболее сложным составом микрофлоры, даже после термической обработки содержит большое количество (10в7 КОЕ/см3) термоустойчивой палочковидной микрофлоры, свойства которой изучены не достаточно и которая была обнаружена во всех образцах сухих продуктов, содержащих творожную сыворотку.
Для улучшения микробиологических показателей молочной сыворотки необходимо четко соблюдать установленные технологические параметры процесса выработки готового продукта; исключить повторное обсеменение сырья в процессе технологической переработки. Так, например, если процесс сквашивания при производстве творога длится более 14 часов, то сначала не сквашенное молоко приобретает тягучесть, титруемая кислотность сгустков всего 28-30 °Т, кокковая микрофлора в микропрепаратах исчезает, появляются зернистые термоустойчивые палочки. Затем титруемая кислотность поднимается до 300 °T, идет протеолиз белка (сгусток разжижается), выход продукции низкий. Чем быстрее происходит сквашивание молока, тем меньше возможность развития БГКП, так как интенсивное снижение pH среды в сквашенном молоке подавляет их развитие.
В весеннее и осеннее время года наблюдается ухудшение качества молока и активное развитие сопутствующей, посторонней микрофлоры, в том числе бактериофага. Поэтому в эти периоды требуется не только интенсивная мойка и контроль за ее качеством, но и необходимы особенно активные, стойкие и устойчивые по отношению к фагу закваски.
Проведенные целевые, широкомасштабные исследования позволили сформулировать положение о наличии в биоценозе технологической обработки молочной сыворотки типичных микроорганизмов, которые были специально изучены.
Специфическая микрофлора молочной сыворотки. Для микрофлоры сыворотки и продуктов ее переработки характерен ограниченный круг микроорганизмов с определенными морфологическими, культуральными и биохимическими свойствами. Как писал классик технической микробиологии С. А. Королев, «... одно из основных положений микробиологии — однородная обстановка создает и однородную микрофлору». Действительно, сыворотка имеет совершенно определенный состав, который представлен лактозой (3,2-4,8%), молочными белками (0,5-1,5%), минеральными веществами (0,3-0,8%) и остатками жира (0,05-0,5%), находящимися в водном растворе с благоприятной для микроорганизмов концентрацией сухих веществ (4,2-7,4)%. Кроме того, общие процессы обработки молока при получении молочной сыворотки, а также переработки ее в сухие продукты способствуют формированию строго определенного круга остаточной микрофлоры. Последняя отличается повышенной устойчивостью к различным неблагоприятным факторам среды, в том числе к высокой температуре, изменению кислотности, низкому содержанию влаги.
Наиболее типичные группы и виды микроорганизмов, встречающихся в сыворотке на всех этапах ее переработки, сохраняются и в готовых продуктах в течение длительного времени. В основном это термоустойчивая микрофлора, попадающая в сыворотку из молока, выдерживающая температуру пастеризации, а также с поверхности оборудования. Причиной термоустойчивости является способность к образованию покоящихся форм. Среди них известные и изученные покоящиеся формы — эндоспоры и спорообразующие палочки рода Bacillus. Доля спорообразующих палочек в общем составе микрофлоры меняется от 10 % в свежей сыворотке до 30% в пастеризованной, а в сухих продуктах из сыворотки — от 7 до 66% (в зависимости от метода обработки и срока хранения).
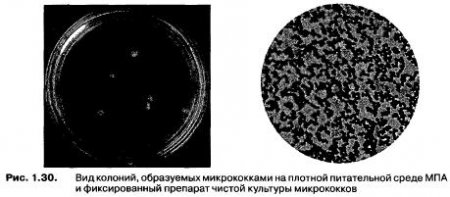
Из-за активных протеолитических свойств Bacillus относятся к группе технически вредных микроорганизмов, способных вызывать пороки готовых продуктов, связанные с распадом белка, горький вкус, неприятный привкус и запах, неоднородная консистенция. Гораздо более удивительна способность к выживанию при пастеризации кокковых форм микроорганизмов. В процессе работы с сывороткой постоянно исследователи сталкивались с микроорганизмами, способными образовывать на МПА округлые, гладкие, выпуклые, глянцевые колонии белого цвета с ровным краем и маслянистой консистенцией диаметром 2-4 мм. В микропрепаратах обнаруживались грамвариабельные кокки в разных сочетаниях — расположенные одиночно, парами, скоплениями, в виде цепочек. Колонии, образуемые данным микроорганизмом при культивировании в течение 24-48 ч при температуре 30 °С и результаты микроскопирования препарата культуры изображены на рис. 1.30.
Эта культура — одна из немногих, сохраняющих жизнеспособность не только после разнообразной тепловой обработки, но и после щелочной изомеризации (pH 11 при 70-75 °С) при высоком осмотическом давлении (в сиропах лактулозы с массовой долей сухих веществ около 70 % как минимум в течение 5 лет), а также в сухих сывороточных продуктах.
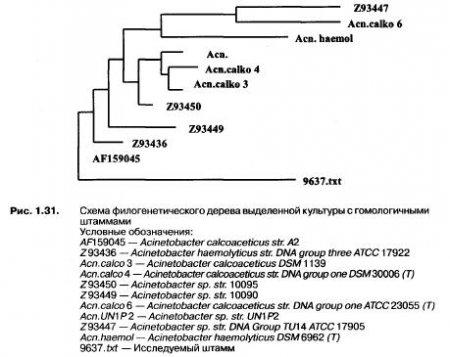
Поэтому именно эти микроорганизмы исследовались более тщательно и затем были переданы в ФГУП ГосНИИ генетики (Москва) для идентификации с использованием анализа 16S-pPHK, с помощью полимеразной цепной реакции (ПЦР). Первичный анализ сходства нуклеотидных последовательностей генов 16S-pPHK изучаемой культуры проводили с помощью специализированных компьютерных программ и каталогов. Скрининг показал, что исследуемый штамм принадлежит к следующим систематическим группам: Bacteria → Proteobacteria → Gammaproteobacteria → Pseudomonadales → Moraxellaceae → Acinetobacter → Acinetobacter calcoaceticus, причем гомология составила 98 %. Последовательности были выровнены с соответствующими последовательностями ближайших видов бактерий, доступными из базы данных GenBank.
По данным анализа было построено филогенетическое дерево с гомологичными штаммами, представленное на рис. 1.31.
Критерием отнесения микроорганизма к тому или иному виду считается гомология не менее 97%. По этому критерию анализируемый штамм с большой долей вероятности был отнесен к виду Acinetobacter calcoaceticus. Возможно, высокая устойчивость этого вида к неблагоприятным условиям среды обусловлена способностью к образованию покоящихся форм — акинет.
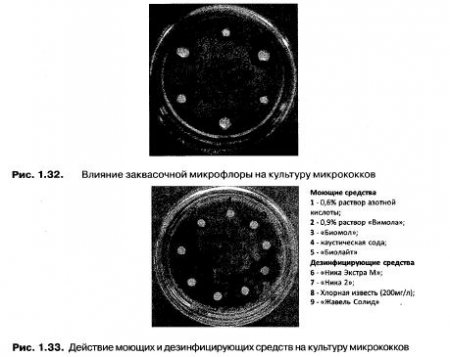
C точки зрения возникновения пороков молочной продукции Acinetobacter calcoaceticus не представляет опасности, так как медленно развивается в молоке. Возможно, он даже вступает в симбиотические отношения с некоторыми видами заквасочной микрофлоры. Наличие Aсinetobacter calcoace+ticus в пищевых продуктах влияет на стандартный микробиологический показатель КМАФАнМ, а также может приводить к порче готовой продукции, прежде всего мясной, так как обладает протеолитическими свойствами (разжижение желатина). В связи с приведенными данными представляет интерес определение способов подавления развития данного микроорганизма. Один из способов — подавление заквасочной культурой. Для определения антибиотической активности заквасочной культуры применяли луночный метод. Влияния заквасочной микрофлоры на культуру микрококков показано на рис. 1.32.
Наибольшую антибиотическую активность по отношению к культуре микрококков проявили ацидофильная палочка (6) и бактериальный концентрат для йогурта (4), содержащий термофильный стрептококк и болгарскую палочку. При этом закваски, содержащие индивидуально либо болгарскую палочку, либо термофильный стрептококк, оказывают значительно меньшее влияние на культуру микроорганизма. Наименьшую антибиотическую активность проявляют закваска для сметаны и термофильный стрептококк.
Второй способ подавления микрококков — использование моющих и дезинфицирующих средств. При исследовании воздействия на культуру моющих и дезинфицирующих средств, используемых в пищевой промышленности, применяли метод бумажных дисков. Действие моющих и дезинфицирующих средств на культуру микрококков показано на рис. 1.33.
Из всех моющих средств на культуру наибольшее влияние оказывает «Биомол» и «Биолайт», из дезинфицирующих средств большая задержка роста наблюдается в присутствии средства «Ника Экстра М».
Полученные результаты говорят об устойчивости выделенной культуры микрококков к большинству средств, применяемых в промышленности для мойки. Вместе с тем, для мойки промышленного оборудования целесообразно применение средства «Биомол», представляющего собой оптимизированную смесь комплексообразующих моющих компонентов и ингибиторов коррозии в комбинации с каустической содой для усиления эффективности очищающего действия. Также возможно использование средства «Биолайт», которое представляет собой смесь органических и неорганических кислот, комплексообразователей, ингибиторов коррозии и пеногасителей. Для уничтожения термо- и осмоустойчивой кокковой микрофлоры целесообразно применение «Биолайта» в комбинации с азотной кислотой. Для дезинфекции машин и аппаратов необходимо применять средство «Ника Экстра М», которое в качестве действующего агента содержит алкилдиметилбензил-аммонийхлорид — 3,5-4,5 %. К микрофлоре, выдерживающей температуры пастеризации, относят также термоустойчивые палочки.
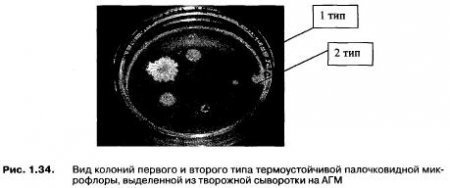
С целью изучения свойств технически вредных микроорганизмов, вызывающих в готовых продуктах пороки, было проведено выделение чистых культур термоустойчивой палочковидной микрофлоры из образцов творожной сыворотки. В результате культивирования творожной сыворотки на АГМ чаще всего вырастали колонии двух типов. Колонии первого типа — глянцевые, вязкие, матовые, округлой формы, диаметром 7-9 мм. Колонии второго типа — выпуклые, глянцевые, с неровным краем и рельефной поверхностью, диаметром 5-7 мм. Чистые культуры термоустойчивой микрофлоры затем подвергали анализу для определения культуральных и биохимических свойств. На рис. 1.34 представлены колонии первого и второго типа, микроскопический анализ которых показал наличие спорообразующей палочки в колонии первого типа и зернистой палочки в колонии второго типа. По результатам исследований была проведена идентификация выделенной микрофлоры в соответствии с определителями микроорганизмов.
Наиболее близки по свойствам к выделенным чистым культурам могут быть Bacillus calidolactis (колонии первого типа) и Bacillus lactis album, Bacillus lactis brevis (колонии второго типа). При дальнейшем изучении выделенной чистой культуры термоустойчивой палочковидной микрофлоры оказалось, что эти культуры давали высокую кислотность в молоке только совместно с мезофильной закваской.
Проведенные исследования по подавлению выявленной микрофлоры заквасочной культурой и моющими и дезинфицирующими средствами показали
— наибольшую антибиотическую активность по отношению к термоустойчивой палочке проявила ацидофильная палочка. Йогуртная закваска и закваска для творога подавляли ее рост в меньшей степени, а наименьшую активность показали закваски для сметаны и сыров;
— устойчивость термоустойчивой палочковидной микрофлоры к большинству средств, применяемых в молочной промышленности для мойки оборудования.
Вместе с тем, существуют дезинфицирующие средства, способные уничтожать данный вид микроорганизма. К таким средствам можно отнести перекись водорода, «Ника Экстра М», действующим агентом которого является алкилдиметилбензил-аммонийхлорид и «Жавель Солид», который в качестве действующего вещества содержит натриевую соль дихлоризоциануровой кислоты. Следует также отметить, что эффективность применяемых средств зависит от времени их хранения, то есть, для достижения требуемого результата мойки и дезинфекции необходимо использовать растворы непосредственно после их приготовления.
Данные исследования, проведенные в лабораторных и производственных условиях, позволяют выделить следующие основные технологические факторы, в наибольшей степени влияющие на микробиологическую обсемененность молочной сыворотки и продуктов на ее основе:
— вид сыворотки и способ ее получения, причем ряд сырья с обсемененностью от меньшей к большей выглядит следующим образом: подсырная сыворотка → творожная сыворотка из ванн → творожная сыворотка с механизированной линии;
— режимы хранения сыворотки и полуфабрикатов (необходимо охлаждение до 10 °С, продолжительность хранения — не более 24 ч);
— режимы тепловой обработки;
— условия хранения готовой продукции;
— условия мойки и дезинфекции.
- Биотермодинамические параметры молочной сыворотки
- Прогнозирование показателей качества творожной сыворотки
- Оценка качества творожной сыворотки с применением мультисенсорной системы
- Идентификация и определение осмофорических компонентов творожной сыворотки
- Обоснование проблематики осмофорических соединений молочной сыворотки
- Технологические свойства молочной сыворотки
- Другие составные части молочной сыворотки
- Витаминный комплекс молочной сыворотки
- Минеральный комплекс молочной сыворотки
- Углеводный комплекс молочной сыворотки
- Азотсодержащий комплекс молочной сыворотки
- Липидный комплекс молочной сыворотки
- Состав, свойства и ценность молочной сыворотки
- Характеристика молочной сыворотки как биотехнологической системы
- Общие положения о мониторинге молочной сыворотки
- Хронология российских разработок в области маслоделия
- Спреды в России: ассортимент, качество, сфера использования
- Научные аспекты развития российского маслоделия
- Особенности состава, свойств и качества сливочного масла разных методов производства
- Вопросы маслообразования в исследованиях российских ученых
- Оригинальные теоретические исследования российских ученых в области маслоделия
- Проблематичность использования в маслоделии молока, содержащего посторонние химические вещества
- Обоснование температурных режимов хранения сливочного масла
- Прогнозирование и оценка консистенции сливочного масла
- Сливочное масло «Стандарт-2000»
- Особенности вкусового букета российского сладко-сливочного масла
- Оригинальность российского ассортимента масла из коровьего молока
- Из истории ВНИИ маслоделия и сыроделия
- Угличский координационный центр развития отечественного маслоделия
- Государственный статус и научные основы отечественного маслоделия