Состав молочного сырья - Сывороточные белки (часть 2)
Денатурация белков молока может быть вызвана воздействием высоких температур; давлением и напряжением сдвига; ультрафиолетовым или ионизирующим излучениями; действием ферментов, органических растворителей (спирт, ацетон), химических веществ, реагирующих с функциональными группами на поверхности белка, и другими факторами. Денатурация — это изменение структуры белка по сравнению с его нативным состоянием. Результат денатурации — развертывание третичной и вторичной структур и высвобождение расположенных внутри них функциональных групп. Разрыв гидрофобных связей, поддерживающих третичную и вторичную структуры белков, ведет к развертыванию нативной специфической структуры молекул белков и образованию произвольной конфигурации. Связи, ранее поддерживающие структуру, высвобождаются и могут по-новому ориентироваться. Функциональные группы, которые первоначально размещались внутри глобул белков, а теперь также участвуют в формировании связей, вступают во взаимодействие с другими молекулами белка. При этом белок теряет растворимость, агрегирует и коагулирует.
Денатурация молочных белков, вызванная нагреванием, действием ферментов и условиями хранения, создает ряд проблем в практике молочной промышленности, так как при этом часто снижается качество готовой продукции.
Тепловой денатурации в основном подвержены сывороточные белки. Самым нестабильным при нагревании является β-лактоглобулин. При нагревании молока до 60 °С β-лактоглобулин распадается на мономеры, которые при дальнейшем нагревании агрегируют за счет образования —S—S— связей:
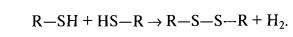
Тепловая денатурация р-лактоглобулина приводит к коагуляции агрегированного белка (он коагулирует почти полностью при 85—100 °С). Кроме того, β-лактоглобулин образует комплексы с æ-казеином казеиновых мицелл и осаждается вместе с ними при коагуляции казеина. Этот комплекс значительно уменьшает воздействие на æ-казеин сычужного фермента и снижает термоустойчивость белков молока.
Термолабильными являются также иммуноглобулины, которые денатурируют при температуре выше 70 °С. Самым термоустойчивым из сывороточных белков является α-лактальбумин. Он содержит четыре дисульфидные связи (—S—S—) в отличие от β-лактоглобулина, который содержит две дисульфидные связи и одну свободную сульфгидрильную группу (SН-). Большая устойчивость α-лактальбумина к нагреванию обусловливается обратимостью денатурированного белка: после охлаждения наблюдается восстановление его нативной структуры за счет самопроизвольного повторного свертывания цепей. Этот процесс называют ренатурацией.
- Состав молочного сырья - Сывороточные белки (часть 1)
- Состав молочного сырья - Казеины (часть 3)
- Состав молочного сырья - Казеины (часть 2)
- Состав молочного сырья - Казеины (часть 1)
- Состав молочного сырья - Белки
- Состав молочного сырья - Вода (часть 2)
- Состав молочного сырья - Вода (часть 1)
- Характеристика молочного сырья
- Виды молочного сырья (часть 2)
- Виды молочного сырья (часть 1)
- Дезинфекция оборудования (часть 2)
- Дезинфекция оборудования (часть 1)
- Мойка оборудования (часть 3)
- Мойка оборудования (часть 2)
- Мойка оборудования (часть 1)
- Бактериофаги
- Применение ферментных препаратов
- Приготовление заквасок в производстве (часть 2)
- Приготовление заквасок в производстве (часть 1)
- Подбор бактериальных препаратов
- Сгущение и сушка молочного сырья (часть 5)
- Сгущение и сушка молочного сырья (часть 4)
- Сгущение и сушка молочного сырья (часть 3)
- Сгущение и сушка молочного сырья (часть 2)
- Сгущение и сушка молочного сырья (часть 1)
- Изменение компонентов молока при тепловой обработке (часть 3)
- Изменение компонентов молока при тепловой обработке (часть 2)
- Изменение компонентов молока при тепловой обработке (часть 1)
- Физические и химические способы инактивации микрофлоры
- Тепловая обработка молока (часть 5)
