Титрованные растворы из концентрированных растворов кислот
При отсутствии фиксаналов точные растворы кислот готовят из концентрированных кислот, плотность которых определяют ареометром. Установку титра и коэффициента поправки к концентрации приготовленного раствора кислоты проводят по титрованному раствору щелочи или гидролитически щелочной соли.
Приготовление 0,1 н. раствора HCl. Раствор готовят из концентрированной или разбавленной соляной кислоты, плотность которой уточняют по ареометру. По таблице (см. приложение) находят точное содержание НС1 (г/л-1) и вычисляют объем соляной кислоты, необходимый для приготовления титрованного раствора.
Предположим, необходимо приготовить 20 л 0,1 н. НСl из концентрированной соляной кислоты, плотность которой по ареометру равна 1,19 г-см-3. Исходя из эквивалентной массы соляной кислоты (36,46), для приготовления 1 л 0,1 н. ее раствора требуется 3,646 г НС1, а для приготовления 20 л 0,1 н. соляной кислоты потребуется 72,93 г (3,646x20) НСl. Далее по таблице находят, что при температуре 20°С концентрированная соляная кислота (пл. 1,19 г/см-3) содержит 455,8 г/л-1 НСl. Следовательно, для того чтобы приготовить 20 л 0,1 н. НСl, необходимо взять 160 мл концентрированной соляной кислоты (72,93 : 455,8 = 159,98 мл).
Концентрированную соляную кислоту отмеривают цилиндром в вытяжном шкафу и переливают в бутыль (заранее отградуированную), мерный цилиндр 2-3 раза ополаскивают дистиллированной водой, и объем раствора доводят водой до 20 л.
Для приготовления 1 л 0,5 н. НCl потребуется 18,23 г (или 40 мл) концентрированной соляной кислоты (пл. 1,19), а для приготовления 20 л 0,5 н. ее раствора следует взять 364,5 г НСl (или 800 мл) концентрированной кислоты.
Пользуясь приведенным расчетом, можно легко приготовить любое количество раствора кислоты нужной концентрации.
Приготовление 0,02 н. раствора серной кислоты. Раствор готовят из химически чистой концентрированной серной кислоты, плотность которой устанавливают по ареометру. Если используется 95,7%-ная серная кислота (пл. 1,835 г/см-3), то при температуре 20°С она содержит 1757 г/л-1 H2SO4. Исходя из эквивалентной массы серной кислоты (49,04), находим, что для приготовления 1 л 0,02 н. ее раствора требуется 0,981 г H2SO4, а для приготовления 20 л 0,02 н. раствора - 19,62 г. Поскольку 1 мл концентрированной серной кислоты (пл. 1,835) содержит 1,727 г H2SO4, то для приготовления 20 л данного раствора следует взять 11,2 мл концентрированной кислоты. Если требуется приготовить 20 л 0,1 н. раствора серной кислоты, то берут 55,8 мл (98,08 г) H2SO4 (пл. 1,835).
Техника приготовления растворов кислоты следующая. Отмеренный цилиндром необходимый объем концентрированной кислоты осторожно приливают в предварительно отградуированную и на четверть заполненную водой бутыль. Затем раствор перемешивают, доводят водой до метки и снова тщательно перемешивают.
Коэффициент поправки к концентрации приготовленной кислоты устанавливают по титрованному раствору гидроксида натрия, тетрабората натрия (буре) или карбоната натрия (соде).
Установление титра кислот. Для установления точной концентрации вновь приготовленных или длительно хранящихся нормальных и молярных растворов кислот используют фиксаналы щелочей или гидролитически щелочные соли с большой молекулярной массой постоянного химического состава. Наиболее удобен для этих целей тетраборат натрия (бура) или карбонат натрия. Для получения тетрабората натрия, химический состав которого точно соответствует формуле Na2B4C7 • 10 Н2O, его перекристаллизовывают из насыщенного при температуре 57-60°С раствора. При более высокой температуре раствора бура теряет часть кристаллизационной воды, и ее молекулярная масса может меняться. Насыщенный раствор буры сначала фильтруют, а затем фильтрат охлаждают до температуры 10-15°С. Образовавшиеся кристаллы отфильтровывают (лучше через воронку Бюхнера) и сушат фильтровальной бумагой до тех пор, пока мелкие кристаллы буры не будут прилипать к стеклянной палочке. Хранят тетраборат натрия в герметичных стеклянных банках.
Большая молекулярная (381,4) и эквивалентная (190,7) масса тетрабората натрия позволяет уменьшить ошибку при взвешивании и достаточно точно приготовить растворы заданной нормальности.
Для установления титра по буре ее раствор готовят такой же нормальности, как и приближенный раствор кислоты, концентрация которой подлежит определению. Так как взять точно рассчитанную навеску на аналитических весах довольно трудно, обычно берут навеску, близкую к расчетной, и вводят коэффициент поправки к титру (нормальности).
Например, для приготовления 200 мл точно 0,01 н. раствора буры необходимо взять навеску 0,3814 г. На аналитических весах была взята навеска буры 0,3865 г. Отсюда коэффициент поправки к нормальности буры равен 1,013 (0,3865/0,3814), а нормальность приготовленного раствора - 0,01013. Следует отметить, что при более концентрированных растворах буры (0,1 н. или 1 н.) или больших объемах коэффициент поправки вследствие уменьшения различия между расчетной и взятой навеской приближается к единице и им можно пренебречь.
Для установления нормальности кислоты в 2-3 конические колбы емкостью 150-200 мл наливают (точно отградуированной пипеткой или из бюретки) по 20 или 25 мл раствора буры, добавляют 2-3 капли раствора индикатора метилового оранжевого и титруют раствором кислоты. Коэффициент поправки к концентрации кислоты находят по формуле
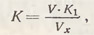
где V - объем раствора тетрабората натрия, мл; К1 - коэффициент поправки к концентрации раствора буры; Vх - объем кислоты, израсходованной на титрование буры.
Если нормальность раствора кислоты устанавливают по точно приготовленному раствору карбоната натрия, то перед взятием навески соль предварительно высушивают при температуре 420-430 К. Молекулярная масса Na2CО3 - 106, эквивалентная масса - 53. Отсюда, чтобы приготовить 1 л 0,1 н. раствора карбоната натрия, необходимо взять 5,3 г, а для приготовления 1 л 0,02 н. раствора - 1,06 г.
Установление титра кислот по навеске соли. На аналитических весах с точностью до 0,0002 г берут 2-3 примерно равные навески гидролитически щелочной соли (буры или соды), переносят в колбы емкостью 150-200 мл и растворяют ее в 20-30 мл воды. Масса навески должна быть в 20-30 раз больше титра раствора соли, эквивалентного нормальности кислоты, т. е. навеска соли должна быть такова, чтобы, растворив ее в 20-30 мл воды, получился раствор соли, нормальность которой близка к нормальности кислоты.
Затем раствор соли титруют раствором кислоты (по метиловому оранжевому), концентрация которой подлежит определению. Поправку к концентрации (титру) кислоты определяют по формуле
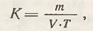
где m - навеска гидролитически щелочной соли, г; V - объем кислоты, пошедшей на титрование соли, мл; Т - титр соли, точно соответствующий нормальности приготавливаемого раствора кислоты, г/мл-1.
Например, требуется установить коэффициент поправки к концентрации приближенного 0,1 н. раствора НСl по навеске тетрабората натрия (буре). Молекулярная масса буры 381,4, эквивалентная - 190,7. Отсюда титр 1 н. раствора буры равен 0,1907 г/мл-1, а 0,1 н. раствора буры - 0,0191 г/мл-1. Удобнее брать такую навеску соли, чтобы ее масса была в 20-30 раз больше титра раствора буры, т. е. 0,4-0,6 г.
Предположим, на титрование 0,475 г буры израсходовано 24,5 мл приближенного 0,1 н. раствора НСl. Находим коэффициент поправки к концентрации кислоты:

Установление титра кислот по навеске карбоната натрия. В отдельные бюксы берут 2-3 навески по 0,15-0,20 г Na2CO3, переносят в конические колбы емкостью 150-200 мл и растворяют в 20-30 мл воды. Бюксы со следами соли снова взвешивают на аналитических весах и по разнице с первоначальным взвешиванием находят массу навески соли.
Пусть требуется установить поправочный коэффициент к концентрации приближенного 0,1 н. раствора кислоты. Исходя из эквивалентной массы Na2CO3 (53), титр 0,1 н. раствора соды равен 0,0053 г/мл-1. Допустим, на титрование 0,154 г Na2CO3 израсходовано 29,5 мл раствора кислоты. Отсюда коэффициент поправки будет равен

а концентрация кислоты будет точно соответствовать 0,0985 н. раствору.
- Производственная кооперация от РосТехАналог
- Системы холодоснабжения
- «Россельзозбанк» кредитует сельских тружеников Пензенского региона
- Инновационная спецтехника в помощь сельским труженикам Самарского региона
- В Самарском регионе заканчивают уборку зерновых
- Компания из Японии построит теплицы для клубники в Хабаровской области
- В деревне Красная Звезда запустили инновационный спортивный корт
- В Нижегородском регионе будут заниматься развитием северных районов
- В Ярославском регионе возведут промышленную корпорацию «Ярославский кролик»
- Фреон – один из наиболее популярных хладагентов
- В Нижегородском регионе возросло производство молока
- Ставропольские персональные подсобные фермерства могут рассчитывать на дополнительную поддержку
- В Рязанском регионе построят ещё один тепличный комплекс
- На экспозиции «Золотая осень» презентуют новейшие сельскохозяйственные разработки
- В Ставропольском регионе увеличится производство картофеля
- Какие бывают топливные брикеты?
- Сферы применения бензиновых воздуходувок
- Сельские труженики Зауралья обговорили Программу развития агротехнической отрасли
- Агрохолдинг «Дон-Агро» приступил к возведению молочной фермы
- За шесть месяцев в Дагестане произведи 418 тысяч тонн молока
- В Кировском муниципалитета действует инновационный агрохимический лабораторный комплекс
- Приготовление титрованных растворов из фиксаналов
- Приготовление растворов для химического анализа
- Источники бесперебойного питания для птицеферм - оправданность необходимости и особенности
- Растворы для химического анализа
- Подготовка химической посуды
- Удобрения для картофеля
- В Липецком регионе собрали почти 23 тысячи тон тепличных овощей
- В Липецкой области состоялось заседание Администрации
- В Пензенском регионе приступили к уборочной страде
