Приготовление растворов для химического анализа
Приготовление растворов требует определенных знаний, практических навыков и аккуратности. Несоблюдение условий приготовления и хранения растворов отрицательно сказывается на достоверности и воспроизводимости результатов анализа. Для приготовления водных растворов необходимо использовать дистиллированную или деминерализованную воду, а при работе с микроэлементами - бидистиллированную или воду, полученную в кварцевых перегонных аппаратах.
Большие количества растворов готовят обычно в бутылях, емкость которых должна на 10-15% превышать объем приготавливаемого раствора. Небольшое количество раствора приготавливают в мерных колбах с притертыми пробками емкостью 0,1-2 л.
Посуда должна быть чистой. Бутыли большой емкости предварительно градуируют восковым карандашом, отмечая каждый раз на внешней стенке бутыли объем прилитой в нее (цилиндром или мерной колбой) воды до тех пор, пока бутыль не заполнится до плеча.
Приготовление приближенных растворов. При подготовке приближенных процентных, молярных и нормальных растворов не требуется высокой точности, поэтому их приготовление значительно упрощается вследствие того, что отпадает необходимость устанавливать коэффициент поправки к концентрации раствора. Навеску можно брать на технических или технохимических весах; массу навески и расчеты округляют до десятой или целой цифры.
Приготовление массовых процентных растворов. Приготовляя процентные растворы из безводных солей и других твердых соединений, необходимую навеску вещества помещают в сухую чистую посуду (стакан, склянку) и растворяют ее сначала примерно в половине отмеренного количества воды, а после растворения вещества добавляют оставшуюся воду и раствор тщательно перемешивают. Например, для приготовления 1 кг 5%-ного раствора сульфата меди 50 г ее безводной соли (CuSО4) растворяют в 950 г воды. Так как при комнатной температуре удельная масса (плотность) воды несущественно отличается от единицы, то вместо взвешивания воду берут мерным цилиндром.
Приготовляя процентные растворы солей, содержащих кристаллизационную воду постоянного состава, в расчетах учитывают массу воды, т. е. массу навески водной соли увеличивают во столько раз, во сколько ее молекулярная масса больше молекулярной массы безводной соли. Так, чтобы приготовить 5%-ный раствор сульфата меди из ее водной соли, нужно 78 г CuSО4 • 5H2О растворить в 922 мл воды.
Аналогичным образом готовят растворы кислот и щелочей. Однако при их приготовлении следует соблюдать необходимые меры предосторожности. Растворение концентрированных кислот и твердых щелочей всегда сопровождается выделением большого количества тепла, что может приводить к разбрызгиванию раствора или растрескиванию стеклянной посуды. Поэтому гидроксид натрия или калия растворяют в фарфоровых или термостойких химических стаканах в вытяжном шкафу при постоянном перемешивании и охлаждении.
Для приготовления растворов кислот необходимое количество концентрированной кислоты берут дозатором или мерным цилиндром и осторожно (особенно при работе с серной кислотой) приливают в воду. Часть воды, отмеренной для приготовления раствора, всегда следует оставлять для ополаскивания используемой посуды. Смыв после ополаскивания присоединяют к общему раствору. Например, для приготовления 1 кг 10%-ного раствора серной кислоты из концентрированной (пл. 1,84 г/см3) кислоты необходимо растворить 105 г (57,2 мл) 95,6%-ной H2SО4 в 895 мл воды. Кислоту отмеряют цилиндром и приливают в воду при постоянном перемешивании и охлаждении.
Для упрощения расчетов при получении растворов нужной концентрации из более концентрированных растворов солей, кислот и оснований путем их разбавления водой или менее концентрированными растворами пользуются правилом смешения (правило диагоналей). Расчет делают следующим образом. Концентрацию приготавливаемого раствора указывают на месте пересечения двух диагоналей, а концентрацию исходных растворов - слева у концов диагоналей. Затем по линии каждой диагонали проводят вычитания одного стоящего на ней числа из другого и полученную разность записывают у правого конца той же диагонали. Полученные числа показывают, сколько следует взять (в единицах массы) раствора, записанного в одном и том же ряду слева, чтобы приготовить раствор заданной концентрации:
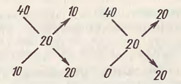
Так, для получения 20%-ного раствора из 40%-ного и 10%-ного необходимо взять 10 единиц массы (г или кг) 40%-ного раствора и 20 единиц массы 10%-ного раствора, т. е. смешать первым (40%-ный) и второй (10%-ный) растворы в соотношении 1 : 2 (по массе). Аналогичные расчеты проводят и при разбавлении более концентрированных растворов водой.
Пусть требуется приготовить 1 кг 20%-ного раствора солянок кислоты из концентрированной (40%-ной) и 10%-ного ее раствора. Удельная плотность 40%-ной и 10%-ной соляной кислоты, найденная по справочной таблице, равна соответственно 1,2 и 1,05 г•см-3. Согласно правилам смешения, находим, что эти растворы необходимо взять в соотношении 10 : 20 (1 : 2), т. е. нужно взять 333 г 40%-ной, 667 г 10%-ной соляной кислоты. Отсюда, учитывая плотность 40%-ного и 10%-ного растворов соляной кислоты, для приготовления 20%-ного ее раствора следует взять 278 мл 40%-ного и 537 мл 10%-ного раствора соляной кислоты.
Приготовление эталонных (образцовых) растворов. Концентрация рабочих эталонных растворов обычно составляет 10в-5 - 10в-7 г•мл-1. Взять точную навеску для приготовления таких растворов довольно сложно, кроме того, при хранении они быстро портятся. Поэтому в лабораторной практике готовят сначала более концентрированные исходные (запасные) образцовые растворы с содержанием 10в-1-10в-3 г•мл-1, из которых в день анализа получают путем разбавления эталонные рабочие растворы нужной концентрации.
Массу навески вещества, необходимого для приготовления эталонного исходного раствора (г•мл-1), рассчитывают по формуле
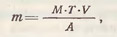
где m - навеска вещества, г; М - молекулярная масса вещества; Т - необходимое содержание элемента или вещества, г•мл-1; V - объем приготавливаемого раствора, мл; А - атомная (ионная или молекулярная) масса определяемого вещества, г.
Приготовление нормальных растворов. Нормальность выражают числом грамм-эквивалентов вещества в 1 л раствора. Для приготовления нормальных растворов используют мерные колбы на 0,5-2 л или предварительно отградуированные бутыли емкостью 5-20 л. Чтобы приготовить, например, 1 н. раствор хлорида калия, отвешивают на технохимических весах 74,56 г (1 грамм-эквивалент) соли и переносят в мерную колбу объемом 1 л. Затем наливают в колбу около половины ее объема дистиллированной воды и перемешивают до полного растворения соли, после чего объем раствора доводят до метки и тщательно перемешивают.
Для приготовления нормальных растворов кислот и оснований необходимо знать химизм протекающих реакций. Так, при взаимодействии фосфорной кислоты с раствором гидроксида калия в зависимости от соотношения кислоты и основания могут образовываться соли: KH2PO4, К2НРО4 и К3РO4. Эквивалентная масса КОН равна 56,1 г. Эквивалентная масса фосфорной кислоты в случае образования однозамещенного фосфата калия равна ее молекулярной массе - 98 г, двухзамещенного - 49 г, трехзамещенного - 32,7 г. Отсюда для приготовления 1 л 1 н. раствора фосфорной кислоты в первом случае необходимо взять 98 г (54 мл), во втором - 49 г (27 мл), в третьем - 32,7 г (18 мл) 98%-ной Н3РO4.
Для приготовления 1 л 1 н. серной кислоты необходимо взять 49,04 г H2SO4 (1 грамм-эквивалент). Раствор готовят следующим образом. В мерную колбу объемом 1 л приливают примерно 0,5 л дистиллированной воды, а затем мерным цилиндром 27,8 мл (49 г) 96%-ной H2SO4. После перемешивания и охлаждения раствор доводят до метки.
Приготовление титрованных растворов. Титрованный раствор - основной рабочий раствор в объемном анализе. Поскольку содержание определяемого вещества рассчитывают по объему титрованного раствора, израсходованного на титрование, достоверность анализа зависит от тщательности его приготовления. Концентрация титрованного раствора должна быть определена с высокой точностью.
Титрованные растворы обычно готовят в тщательно вымытых бутылях емкостью 5-20 л. Растворы, разлагающиеся под действием света, приготавливают в бутылях из темного (коричневого) стекла или обернутых в черную бумагу. Титрованные растворы должны быть изолированы от атмосферного воздуха, так как из него могут поглощаться аммиак, углекислота и другие газы. Бутыль плотно закрывают корковой или резиновой пробкой, снабженной трубкой с поглотителем аскаритом или натронной известью.
Для приготовления титрованных растворов можно использовать безводные и водные химически чистые (х. ч.) или чистые для анализа (ч. д. а.) вещества. Если для работы используют безводные химически чистые соли (например, КСl, KMnO4, K2Cr2O7, AgNO3 и др.), то их навеску рассчитывают исходя из химической формулы с точностью до 0,0002 г. Массу навески для приготовления необходимого количества раствора рассчитывают по формуле
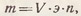
где m - навеска, г; V - объем приготавливаемого раствора, л; э - эквивалентная масса вещества, г; n - нормальность раствора.
Например, для приготовления 2 л 0,1 н. раствора K1 (M - 166,01) на аналитических весах отвешивают 33,202 г (m = 2•0,1•166,01 = 33,202) йодида калия, помещают в мерную колбу, растворяют сначала в небольшом объеме дистиллированной воды, а затем объем раствора доводят водой до 2 л.
Если титрованные растворы готовят из водных растворов солей, имеющих непостоянный состав кристаллизационной воды и веществ, содержащих трудноотделимые примеси (например, КОН и NaOH постоянно содержат примеси карбонатов натрия или калия), то сначала из них готовят растворы с приближенной концентрацией (молярные или нормальные), а затем точно устанавливают концентрацию (титр) приготовленного раствора и вводят коэффициент поправки к концентрации. Коэффициент поправки (К) показывает, на сколько концентрация приготовленного раствора отличается от заданной, т. е. выражает отношение реальной концентрации к заданной, и на сколько нужно умножить объем приготовленного раствора, чтобы получить объем раствора точно заданной концентрации или на сколько следует умножить заданную нормальность (молярность), чтобы получить фактическую.
- Источники бесперебойного питания для птицеферм - оправданность необходимости и особенности
- Растворы для химического анализа
- Подготовка химической посуды
- Удобрения для картофеля
- В Липецком регионе собрали почти 23 тысячи тон тепличных овощей
- В Липецкой области состоялось заседание Администрации
- В Пензенском регионе приступили к уборочной страде
- Консервные компании Дагестана активно перерабатывают абрикосы
- В Татарстане проверили уровень подготовки муниципалитетов к уборочной страде
- В Ростовский регион прибыли специалисты из Южной Кореи
- В Японии создадут круглогодичный комплекс теплиц
- Девятнадцатое предприятие запускает производство товаров в особой экономической зоне «Липецк»
- В подмосковном совхозе уменьшили план по сбору клубники
- Под Саратовом возводят поселение для ветеранов
- Глава Ставрополья проверил ход реконструкции Домов культуры в сёлах
- В Татарстане появится совместное российско-венгерское предприятие по выращиванию материала для посадки
- В Кировском регионе обговорили перспективы развития агротехнической отрасли
- В Амурском регионе заканчивается посев гречихи
- На Алтае приступили к производству итальянского сыра
- Глава Пензенского региона провёл встречу с переработчиками молочного сырья
- Программу «Биотерра» презентовали на «Общегосударственном дне поля»
- В России развивается органическое земледелие
- На Ямале начнут производить сыр и мороженое
- Больше восьмисот тысяч голов мелкого рогатого скота перегнали на летние луга в Дагестане
- В Дагестане занимаются заготовкой кормовой базы
- В Спасском муниципалитете Пененской области состоится обучающее мероприятие «Полевой город»
- Джамбулат Хатуов посетил Орловский регион
- Создание положительного имиджа фирмы с помощью логотипа
- Лабораторное оборудование для химического анализа
- Техника безопасности при работе в агрохимических лабораториях
