Фотометрические методы химического анализа
Принцип фотометрического анализа заключается в сравнении количественного и качественного изменения светового потока (светопоглощения, светорассеивания, светопреломления, вращения плоскости поляризованного света и др.), прошедшего через исследуемый раствор и стандартный раствор с заранее известной концентрацией искомого вещества. Фотометрические методы получили также название методов адсорбционной спектроскопии, так как проходящее через раствор электромагнитное излучение видимой, ультрафиолетовой и инфракрасной области спектра, поглощаются веществом пропорционально его концентрации в растворе.
Среди методов адсорбционной спектроскопии наиболее широкое распространение в агрохимических исследованиях получили колориметрический, фотоэлектроколориметрический и спектрофотометрические методы, значительно отличающиеся сложностью используемой аппаратуры. При колориметрическом анализе не требуется дорогостоящего оборудования, так как он основан на визуальном сравнении интенсивности окраски исследуемого и стандартного растворов. Для фотоэлектроколориметрического анализа применяют относительно несложное оптическое оборудование, позволяющее с помощью набора светофильтров использовать ту или иную широкополосную область видимого спектра света.
Спектрофотометрический метод основан на измерении светопоглощения растворов в узком пучке монохроматического света, что достигается благодаря использованию сложного оборудования, имеющего в своем составе диспергирующую призму или дифракционную решетку.
Теоретическое обоснование колориметрического анализа. При фотометрических анализах определяемое вещество переводят с помощью различных химических реакций в растворимое соединение, поглощающее электромагнитное (световое) излучение, и определяют его оптическую плотность. Так как светоадсорбционные свойства растворов зависят не только от концентрации в нем определяемого вещества, но и от его формы (состояния), важно выбрать такие условия протекания химических реакций, при которых искомое вещество создавало бы максимальную оптическую плотность растворов.
Все фотометрические методы анализа основаны на законе Ламберта - Бугера - Бера. Сущность этого закона состоит в том, что при прохождении светового потока определенной интенсивности (Io) через кювету с исследуемым раствором часть его отражается (Iот), часть адсорбируется (поглощается) раствором (Ia), в результате чего интенсивность светового потока, прошедшего через раствор, снижается (рис. 7). Отсюда уравнение баланса светового потока имеет вид: Io = Iот + Ia + I.
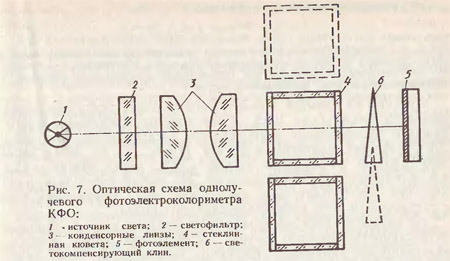
Так как ослабление светового потока в результате отражения на границе воздух - стекло и раствор - стекло относительно невелико и постоянно в кювете с раствором и растворителем, то величиной можно пренебречь. В результате этого уравнение светового потока, прошедшего через раствор, приобретает вид: Io = Ia + I. Интенсивность падающего (Io) и прошедшего через кювету с раствором светового потока (I) можно непосредственно измерить и по разнице Io-I определить величину адсорбции света (Ia), которая не поддается непосредственному измерению. Ослабление светового потока, прошедшего через раствор, зависит от природы вещества, количества молекул в растворе (концентрации) и спектрального состава света.
Все окрашенные соединения оптически активны, т. е. непропорционально поглощают световую энергию разных длин волн спектра видимого света. В результате цвета входящего в раствор и выходящего из него широкополосного светового потока (или дневного света) будут различны. Цвет раствора обусловливается той частью падающего светового потока, которая проходит через раствор, не поглощаясь. В силу этого при определении любого вещества необходимо устанавливать такую длину волны светового потока, при которой его поглощение раствором будет максимальным. Это достигается за счет светофильтров, диспергирующей призмы или дифракционной решетки.
Число фотонов, поглощаемых веществом, зависит от интенсивности светового потока, т. е. от их количества. Чем больше интенсивность светового потока, тем абсолютно большая их величина поглощается раствором. Обычно колориметрические определения проводят при комнатной температуре, при которой практически все молекулы вещества находятся в невозбужденном состоянии. Поглощая фотоны, молекулы кратковременно переходят в колебательное или электронное возбужденное состояние. Доля возбужденных молекул обусловливается природой вещества и интенсивностью светового потока. При небольшой интенсивности излучения число возбужденных молекул в растворе очень мало, так что в растворе находятся преимущественно невозбужденные молекулы, количество которых постоянно при стабильном излучении и концентрации вещества в растворе. При повышении интенсивности светового потока доля возбужденных молекул пропорционально увеличивается, однако это практически не сказывается на числе молекул, остающихся в растворе в невозбужденном состоянии, которое в широком диапазоне интенсивности светового потока будет оставаться практически постоянным. Из этого следует вывод, что число невозбужденных молекул в растворе и интенсивность ослабления светового потока зависят только от концентрации.
Исследованиями П. Бугера и И. Ламберта установлено, что слои раствора равной величины при одинаковых условиях поглощают одну и ту же часть (долю) проходящего через них светового потока.
Этот закон выражается уравнением

где Io и I - соответственно интенсивность падающего и проходящего через раствор светового потока; е- основание натурального логарифма; k - коэффициент светопоглощения раствора при определенной концентрации вещества; I - толщина слоя раствора, пронизанного светом.
Поясним на примере. Примем интенсивность любого падающего светового потока Io за 100%. Если при прохождении первого и каждого последующего равновеликого слоя раствора световой поток ослабевает, допустим в 2 раза (I = Io : 2), то через первый слой пройдет 50%, через второй - 25%, через третий - 12,5% и т. д. падающей световой энергии. Это можно наблюдать, например, при последовательном увеличении числа одинаковых кювет с раствором на пути следования светового потока.
Из рассмотренной закономерности следует, что: 1) отношение интенсивности светового потока, прошедшего через раствор, к интенсивности падающего светового потока (I : Io) для данного раствора величина постоянная и не зависит от интенсивности падающего светового потока; 2) если толщина слоя раствора увеличивается в арифметической прогрессии, то интенсивность светового потока, прошедшего через него, уменьшается в геометрической прогрессии. Коэффициент светопоглощения зависит лишь от природы растворенного вещества и длины волны падающего светового потока.
Позднее К. Бер, изучая поглощение света растворами различной концентрации, установил, что коэффициент светопоглощения k прямо пропорционален концентрации вещества в растворе: k =еС, где С - концентрация определенного вещества в растворе; е - коэффициент, зависящий от природы этого вещества.
Объединяя уравнения Бугера - Ламберта - Бера, получим математическое выражение основного закона фотоколориметрии - закона Бугера - Ламберта - Бера:
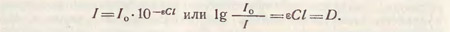
Величину D принято называть оптической плотностью (или экстинцией Е), которая при прочих равных условиях прямо пропорциональна концентрации вещества и толщине поглощающего слоя.
Так как произведение С • l характеризует общее число частиц, которые встают на пути прохождения пучка света, а е характеризует оптические свойства вещества при определенном спектральном составе света, следует, что изменение концентрации раствора или толщины слоя раствора в одинаковое число раз приводит к одинаковому ослаблению проходящего через раствор светового потока, т. е. дает один и тот же эффект. Если концентрацию раствора увеличить в несколько раз, а толщину слоя во столько же раз уменьшить, то оптическая плотность раствора останется неизменной.
В фотометрической практике чаще всего приходится иметь дело с меняющейся концентрацией раствора при постоянной толщине слоя (кюветы). В этом случае необходимо помнить, что при изменении концентрации раствора в n раз светопоглощение меняется в n2 раз, а изменение оптической плотности кратно изменению концентрации раствора.
Например, если оптическая плотность раствора равна 1, это значит, что интенсивность падающего луча в 10 раз выше светового потока, прошедшего через раствор, при повышении содержания данного вещества в растворе вдвое D равна 2, а интенсивность прошедшего через раствор светового потока уменьшится в 100 раз, т. е. составит 1 % интенсивности падающего и т. д.
Наряду с оптической плотностью D в фотоколориметрии для характеристики оптических свойств растворов пользуются иногда такими понятиями, как светопропускание и светопоглощение.
Величина светопропускания (прозрачности) раствора выражает отношение интенсивности светового потока, пройденного через раствор к интенсивности падающего светового потока:
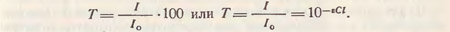
Величина поглощенного света веществом может быть найдена в процентах или долях соответственно:
Молярный коэффициент поглощения. Если концентрация раствора выражена числом грамм-молей в 1 литре (молярная концентрация), а толщина слоя в сантиметрах, величину г принято называть молярным коэффициентом поглощения. Величина молярного коэффициента поглощения обусловливается природой вещества и спектральным составом света и не зависит от интенсивности светового потока.
При концентрации раствора, равной 1 моль/л-1, и толщине слоя раствора 1 см молекулярный коэффициент поглощения численно равен оптической плотности раствора:
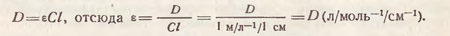
Молекулярный коэффициент поглощения является оптической характеристикой каждого вещества и, как правило, приводится в аналитической литературе. Он не зависит от индивидуальных особенностей используемых приборов. При необходимости молярный коэффициент поглощения легко можно определить. Для этого приготавливают раствор известной молярности и определяют оптическую плотность при известной толщине слоя (кюветы).
Допустим, оптическая плотность 0,01 М раствора равна 1 при измерении его в кювете толщиной 0,1 см. Отсюда

Молярный коэффициент поглощения является мерой чувствительности фотометрических реакций и колеблется обычно в пределах 10в2-10в5. Чем больше его значение, тем выше будет чувствительность анализа. Например, метод определения нитратов, по Гриссу, в 4 раза более чувствителен, чем их определение дисульфофеноловым методом, так как их молярные коэффициенты поглощения соответственно равны 4 •10в4 и 1•10в4 при длине волн 520 и 410 нм.
Выбор длины волны при фотометрическом анализе. Как известно, окраска растворов обусловливается непропорциональным поглощением веществом отдельных участков непрерывного спектра видимого света. Отсюда причиной низкой чувствительности и ошибок при фотоколориметрическом анализе может быть неправильно выбранный спектр света. Наибольшая чувствительность анализа всегда наблюдается в той области спектра света, для которой оптическая плотность раствора максимальна.
Длина волны, соответствующая максимуму светопоглощения, обозначается ?макс. Например, при определении нитритов и нитратов по Гриссу ?макс = 520 нм, аммиачного азота по Несслеру ?макс = 410 нм и т. д. Максимум светопоглощения большей части окрашенных растворов находится в видимой или ультрафиолетовой области спектра. Чтобы найти ?макс, нужно определить оптическую плотность в различных областях спектра, начертить графическую зависимость оптической плотности от длины волны и по вершине кривой светопоглощения выбрать оптимальную длину волны для измерения оптической плотности растворов.
Чувствительность всегда выше при использовании монохроматического спектра света вместо широкополосного. Искажения, вызываемые использованием широкополосных светофильтров, особенно велики при большой плотности (концентрации) растворов, так как доля «паразитного» света, попадающего на фотоэлемент, увеличивается вследствие слабого его поглощения веществом. Для устранения этих недостатков современные чувствительные приборы вместо светофильтров снабжены устройством для получения монохроматического света в диапазоне 200-1100 нм.
- Инструментальные методы химического анализа
- Приготовление титрованных растворов щелочей
- Титрованные растворы из концентрированных растворов кислот
- Производственная кооперация от РосТехАналог
- Системы холодоснабжения
- «Россельзозбанк» кредитует сельских тружеников Пензенского региона
- Инновационная спецтехника в помощь сельским труженикам Самарского региона
- В Самарском регионе заканчивают уборку зерновых
- Компания из Японии построит теплицы для клубники в Хабаровской области
- В деревне Красная Звезда запустили инновационный спортивный корт
- В Нижегородском регионе будут заниматься развитием северных районов
- В Ярославском регионе возведут промышленную корпорацию «Ярославский кролик»
- Фреон – один из наиболее популярных хладагентов
- В Нижегородском регионе возросло производство молока
- Ставропольские персональные подсобные фермерства могут рассчитывать на дополнительную поддержку
- В Рязанском регионе построят ещё один тепличный комплекс
- На экспозиции «Золотая осень» презентуют новейшие сельскохозяйственные разработки
- В Ставропольском регионе увеличится производство картофеля
- Какие бывают топливные брикеты?
- Сферы применения бензиновых воздуходувок
- Сельские труженики Зауралья обговорили Программу развития агротехнической отрасли
- Агрохолдинг «Дон-Агро» приступил к возведению молочной фермы
- За шесть месяцев в Дагестане произведи 418 тысяч тонн молока
- В Кировском муниципалитета действует инновационный агрохимический лабораторный комплекс
- Приготовление титрованных растворов из фиксаналов
- Приготовление растворов для химического анализа
- Источники бесперебойного питания для птицеферм - оправданность необходимости и особенности
- Растворы для химического анализа
- Подготовка химической посуды
- Удобрения для картофеля
