Приготовление титрованных растворов щелочей
Титрованные растворы гидроксида натрия и калия готовят из фиксанала или путем установления титра приближенных нормальных (молярных) растворов щелочей. Для приготовления 1 л 0,1 н. раствора гидроксида натрия берут (на часовом стекле или в бюксе) 4 г NaOH, переносят в мерную колбу емкостью 1 л, остатки щелочи смывают в колбу дистиллированной водой и после ее растворения доводят объем раствора до метки. Затем определяют титр щелочи по титрованному раствору кислоты.
Титрованный раствор NaOH, свободной от Na2CО3, получают из его насыщенного раствора. Сначала в цилиндре или склянке готовят примерно 50%-ный раствор щелочи, закрывают пробкой и оставляют на несколько дней. Перед приготовлением титрованного раствора щелочи берут пипеткой 1 мл прозрачного концентрированного раствора и переносят в коническую колбу емкостью 200-250 мл, добавляют 2-3 капли фенолфталеина и титруют 0,5 н. раствором серной или соляной кислоты. Концентрацию (титр) насыщенного раствора щелочи (г/мл-1) определяют по формуле: С = VК • 0,02, где V - объем 0,5 н. кислоты, израсходованной на титрование, мл; К - коэффициент поправки 0,5 н. раствора кислоты; 0,02 - количество NaOH (в г), эквивалентное 1 мл точно 0,5 н. кислоты.
Допустим, на титрование 1 мл насыщенного раствора щелочи пошло 24,5 мл точно 0,1 н. HCI (К = 1), тогда концентрация NaOH в растворе будет равна 49% (24,5 • 0,02 • 100). Отсюда легко рассчитать, сколько потребуется концентрированного раствора щелочи для приготовления необходимого количества раствора любой концентрации.
Например, для приготовления 1 л 0,1 н. раствора гидроксида натрия требуется 4 г NaOH, для приготовления такого же раствора в количестве 20 л потребуется 80 г NaOH. Далее находим объем 49%-ного раствора щелочи, чтобы в нем содержалось 80 г NaOH. Простым расчетом определяют, что для приготовления 20 л 0,1 н. NaOH необходимо взять 163,3 мл 49%-ной щелочи, а для приготовления 20 л 0,5 н. раствора щелочи - 816 мл.
Следует отметить, что концентрация растворов щелочей может меняться в результате растворения стекла и поглощения СО2 из воздуха. Поэтому бутыли, предназначенные для длительного хранения титрованных растворов щелочей, следует изнутри парафинировать, а их пробки снабдить поглотителем углекислоты.
Установление нормальности растворов щелочей. Для установления нормальности (титра) растворов щелочей используют растворы кислот, приготовленные из фиксанала, или растворы кислот, точная концентрация которых установлена с помощью поправочного коэффициента. При отсутствии фиксаналов концентрацию (нормальность) щелочей устанавливают по навеске или точно приготовленному раствору янтарной (СН2 • СООН)2, щавелевой (Н2С2О4 • 2Н2О) и сульфаминовой (NH2SO3H) кислоты.
Установление нормальности раствора щелочи по титрованному раствору кислоты. В 2-3 конические колбы емкостью 150-200 мл наливают по 20 (или 25 мл) точно приготовленного (из фиксанала) раствора серной или соляной кислоты, добавляют 2-3 капли раствора метилового оранжевого и титруют раствором щелочи до перехода оранжево-розовой окраски в желто-зеленую. Затем добавляют 2-3 капли раствора фенолфталеина и титруют до появления розовой окраски. Коэффициент поправки рассчитывается дважды (по метиловому оранжевому и по фенолфталеину):
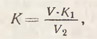
где V - объем титрованной кислоты, мл; K1 - коэффициент поправки к концентрации кислоты (для кислоты, приготовленной из фиксанала, K1 = 1); V2 - объем щелочи, израсходованной на титрование.
Расхождение между коэффициентами поправки щелочи, установленными по метиловому оранжевому и по фенолфталеину, свидетельствуют о загрязнении щелочи карбонатами.
Допустим, на титрование 25 мл 0,1 н. раствора H2SО4, имеющего поправку к титру 1,018 (т. е. 25 мл 0,1018 н. раствора кислоты), израсходовано 25,3 мл 0,1 н. раствора NaOH. Отсюда коэффициент поправки щелочи равен (25 • 1,018 : 25,3) = 1,006, а ее концентрация - 0,1006 н.
Установление нормальности раствора щелочи по навеске или титрованному раствору янтарной кислоты. Янтарная кислота С4Н6О4 не содержит кристаллизационной воды, что дает возможность использовать ее для проверки нормальности растворов щелочей. Молекулярная масса янтарной кислоты равна 118,09, эквивалентная - 59,05. Для приготовления 1 л 0,1 н. титрованного раствора янтарной кислоты берут навеску точно 5,906 г, а для приготовления 1 л 0,5 н. раствора - 29,52 г. Если навеска отличается от расчетной, вводят коэффициент поправки, который будет равен отношению массы расчетной (теоретически необходимой) к массе взятой навески для приготовления раствора.
Нормальность щелочи по раствору янтарной кислоты проверяют по фенолфталеину, в остальном аналогично установлению титра раствора щелочи по титрованному раствору соляной или серной кислот.
Установление нормальности раствора щелочи по навеске янтарной кислоты. На аналитических весах с точностью до 10в-3 г берут навеску янтарной кислоты, масса которой должна быть такой, чтобы при растворении в 20-30 мл воды нормальность ее раствора была близка к нормальности щелочи. При установлении титра 0,1 н. раствора NaOH масса навески янтарной кислоты должна составлять 0,2-0,3 г. Для проверки 0,5 н. NaOH берут 1-1,2 г янтарной кислоты. Навеску кислоты переносят в коническую колбу емкостью 150-200 мл, растворяют в 20-30 мл воды, добавляют 2-3 капли раствора фенолфталеина и титруют раствором щелочи. Коэффициент поправки к титру (концентрации) раствора щелочи определяют по формуле

где m - масса навески янтарной кислоты, г; V - объем щелочи, израсходованной на титрование навески кислоты, мл; Т - титр янтарной кислоты (г/мл-1) при эквивалентной ее концентрации с раствором щелочи.
Для 0,1 н. раствора янтарной кислоты титр равен 0,0059 г-мл-1, для 0,5 н. раствора - 0,0295 г-мл-1 и т. д.
Наряду с янтарной кислотой в аналитической практике для установления нормальности растворов щелочей широко используют щавелевую и сульфаминовую кислоты. Методика определения нормальности раствора щелочи с помощью этих кислот аналогична описанной выше для янтарной кислоты.
- Титрованные растворы из концентрированных растворов кислот
- Производственная кооперация от РосТехАналог
- Системы холодоснабжения
- «Россельзозбанк» кредитует сельских тружеников Пензенского региона
- Инновационная спецтехника в помощь сельским труженикам Самарского региона
- В Самарском регионе заканчивают уборку зерновых
- Компания из Японии построит теплицы для клубники в Хабаровской области
- В деревне Красная Звезда запустили инновационный спортивный корт
- В Нижегородском регионе будут заниматься развитием северных районов
- В Ярославском регионе возведут промышленную корпорацию «Ярославский кролик»
- Фреон – один из наиболее популярных хладагентов
- В Нижегородском регионе возросло производство молока
- Ставропольские персональные подсобные фермерства могут рассчитывать на дополнительную поддержку
- В Рязанском регионе построят ещё один тепличный комплекс
- На экспозиции «Золотая осень» презентуют новейшие сельскохозяйственные разработки
- В Ставропольском регионе увеличится производство картофеля
- Какие бывают топливные брикеты?
- Сферы применения бензиновых воздуходувок
- Сельские труженики Зауралья обговорили Программу развития агротехнической отрасли
- Агрохолдинг «Дон-Агро» приступил к возведению молочной фермы
- За шесть месяцев в Дагестане произведи 418 тысяч тонн молока
- В Кировском муниципалитета действует инновационный агрохимический лабораторный комплекс
- Приготовление титрованных растворов из фиксаналов
- Приготовление растворов для химического анализа
- Источники бесперебойного питания для птицеферм - оправданность необходимости и особенности
- Растворы для химического анализа
- Подготовка химической посуды
- Удобрения для картофеля
- В Липецком регионе собрали почти 23 тысячи тон тепличных овощей
- В Липецкой области состоялось заседание Администрации
