Потенциометрия
Принцип метода. Потенциометрия относится к экспресс-методам. Используя несложное оборудование (потенциометры-ионометры), можно быстро и с высокой точностью определить концентрацию (активность) различных ионов в растворах и суспензиях. В агрохимических исследованиях особенно широко потенциометрический метод используют для определения концентрации катионов (Н+, Na+, К+ Li+ и др.) и анионов (NO3-, CI-, Br-, J- и др.), в почве и растениях, а также окислительно-восстановительного состояния почвы.
Потенциометрические методы основаны на измерении величины окислительно-восстановительного потенциала, возникающего на границе раздела твердой и жидкой фазы. Если металлический электрод (пластинку или проволочку) поместить в раствор, то под влиянием полярных молекул растворителя (например, воды) некоторая часть поверхностно расположенных катионов металла, гидратируясь, будет переходить в раствор, а оставшиеся в кристаллической решетке металла избыточное количество электронов, которые не в состоянии свободно переходить в раствор вместе с катионами, будут накапливаться на границе металл - раствор, создавая тем самым определенный электродный потенциал. Этот процесс обратимый, так как наряду с переходом катионов металла в раствор (окисление) часть их обратно осаждается из раствора на поверхности кристаллической решетки металла (восстановление).
Обратимость данного процесса обусловливается тем, что по мере увеличения количества катионов, перешедших из металла в раствор, возрастающий на его поверхности отрицательный потенциал будет препятствовать дальнейшему переходу катионов металла в раствор и, наоборот, заметно увеличится скорость осаждения (восстановления) катионов на поверхности электрода. Следует отметить, что ионы металла, перешедшие в раствор, не распространяются равномерно по всему объему жидкости, а концентрируются под влиянием электростатического притяжения электронов у поверхности электрода, образуя двойной электрический слой. Когда скорости перехода катионов из металла в раствор и обратно будут равны, устанавливается динамическое (подвижное) электрохимическое равновесие системы. Возникающий между поверхностью электрода и катионами прилегающего слоя раствора потенциал называется равновесным потенциалом. Зависит он от природы металла, температуры и состава раствора. Так как отдельные металлы отличаются различной прочностью кристаллической решетки, а следовательно, и способностью отдавать свои катионы в раствор, то их равновесные потенциалы также будут различны. Металлы с прочной кристаллической решеткой (плагина, золото, серебро и др.) слабо отдают свои ионы в раствор и, наоборот, обладают высокой способностью удерживать (осаждать) на своей поверхности одноименные катионы из раствора, в результате чего электрод приобретает избыточный положительный заряд, а приэлектродный слой раствора - отрицательный за счет оставшихся в нем нескомпенсированных анионов. Металлы с менее прочной кристаллической решеткой более активны, они легче отдают свои катионы в раствор, поэтому электроды, изготовленные из них, имеют более отрицательный равновесный потенциал.
Потенциал электрода зависит также от концентрации соли в растворе. Исходя из рассмотренного выше динамического равновесия, повышение концентрации катионов металла в растворе будет препятствовать переходу ионов с поверхности металлического электрода в раствор, вследствие чего равновесный потенциал становится более положительным. Зависимость равновесного электродного потенциала от концентрации раствора выражается уравнением Нернста:
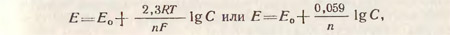
где Ео - стандартный электродный потенциал (потенциал 1 н. раствора); R - газовая постоянная, равная 8,31 Дж/град-1/мол-1; Т - абсолютная температура; F - число Фарадея, равное 96500 к/л; n - заряд иона; С - концентрация ионов металла в растворе; 2,3 коэффициент перевода натуральных логарифмов в десятичные; 0,059 - коэффициент, равный 2,3 RT•F-1
В окислительно-восстановительных реакциях электродный потенциал обусловливается концентрацией окислителя и восстановителя в растворе.

где ОХ и Red - соответственно концентрации окисленной и восстановленной формы ионов раствора; Еo - стандартный нормальный электродный потенциал, т. е. потенциал раствора, в котором концентрация окислителя и восстановителя равна 1 н.
Потенциал отдельного электрода непосредственно не может быть измерен, поэтому его всегда определяют по отношению к стандартному водородному электроду или электроду, стандартный потенциал которого известен. Электрод с известным стабильным стандартным потенциалом называется вспомогательным или электродом сравнения, а электрод, потенциал которого измеряют, - индикаторным. Оба электрода (полуэлементы) вместе представляют собой гальванический элемент (гальваническую пару) с определенной, зависящей от концентрации раствора и типа электродов, ЭДС, которую можно легко измерить.
Электроды. Выбор электродов - наиболее важный момент в потенциометрии. Известно несколько типов электродов, применяемых в потенциометрии. Выбор индикаторного и вспомогательного электродов определяется прежде всего характером решаемой задачи и типом протекающих реакций. Для измерения окислительно-восстановительного потенциала раствора используют, как правило, индифферентные индикаторные электроды из благородных металлов (платины или золота), которые сами не принимают участия в реакциях, а служат лишь для передачи электронов окислительно-восстановительной системы. Потенциал такого инертного (например, платинового) электрода будет определяться только потенциалом данной системы.
При измерении концентрации отдельных ионов (катионов или анионов) применяют индикаторные электроды, потенциал которых функционально зависит от активности ионов в растворе. Такие электроды называются обратимыми. Известны электроды, которые обратимы к катионам или анионам, а также обладающие определенной селективностью по отношению к отдельным ионам. Линейной зависимостью потенциала от логарифма активности ионов характеризуются металлические, стеклянные и получившие в последнее время широкое распространение высокочувствительные ионоселективные электроды, позволяющие с высокой точностью определять в растворах концентрацию ионов водорода, лития, натрия, калия, нитратов, хлора и др.
Чтобы записи не были громоздкими, концентрацию (активность) сильно разбавленных растворов удобнее выражать в виде отрицательной показательной функции. Чаще всего концентрацию ионов разбавленных растворов выражают через отрицательный десятичный логарифм (lg 1/С) и записывают символом рХ, где р - начальная буква слов Potens, power - показатель, а X - наименование искомого иона. Например, концентрацию ионов водорода 10в-6 моль/л-1 записывают рН = 6 (рН = - lg 10в-6 = 6), при рН = 4,7 концентрация ионов водорода в растворе будет равна 2•10в-5 моль/л-1 (|Н+| = 10-РН; |Н+| = 10в-4,7 = 10-В-5•10в0,3= = 2•10в-5 моль/л-1).
Аналогичным образом через pNa выражают концентрацию натрия, рК - концентрацию калия и т. д.
Стеклянный электрод изготавливают из специального тонкостенного стекла в виде трубки, оканчивающейся небольшим шариком. Внутрь шарика помещен буферный раствор и электрод со стабильным потенциалом, выполняющий функцию проводника тока. Принцип работы стеклянного электрода состоит в следующем. При погружении электрода в раствор содержащиеся в стекле ионы щелочных металлов обмениваются с ионами раствора (например, водорода), в результате чего на наружной поверхности стеклянного шарика образуется определенный, зависящий от концентрации определяемых ионов в растворе равновесный электродный потенциал. Потенциал внутренней стенки шарика по отношению к металлическому электроду - постоянный, так как они имеют контакт с буферным раствором постоянного состава. Поэтому потенциал стеклянного электрода определяется только потенциалом наружной поверхности стеклянного шарика и является функцией рХ (рН, pNa, рК и т. д.).
Для изготовления селективных электронов в настоящее время наряду со специальными стеклами широкое распространение получили другие материалы, обладающие ионоселективными свойствами (иониты - катиониты и аниониты).
Используемые в потенциометрии ионоселективные мембранные электроды разделяют на три вида. К первому виду относятся электроды, изготавливаемые на основе твердых ионитов (стеклянные; электроды с полимерной или минеральной ионитовой мембраной и др.); ко второму - электроды с использованием жидких ионитов; третий вид мембран основан на применении специальных нейтральных переносчиков.
Конструктивно ионоселективные электроды схожи между собой и различаются в основном механизмом перемещения определяемых ионов через мембрану и принципом задерживания других посторонних ионов.
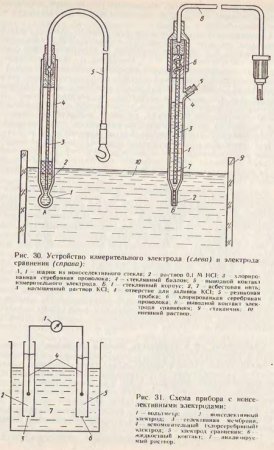
При определении концентрации (активности) ионов в растворе используют два электрода (рис. 30): измерительный ионоселективный электрод А и электрод сравнения Б. Принципиальная схема прибора следующая (рис. 31). Мембрана 3 ионоселективного электрода разделяет внутренний раствор с постоянной концентрацией и наружный испытуемый раствор, из которого определяемые ноны могут диффундировать через мембрану во внутренний раствор. Так как мембрана электрода проницаема только для строго определенного вида ионов, то при диффузии через нее возникает электродный потенциал, по мере возрастания которого устанавливается электрохимическое равновесие, препятствующее дальнейшему проникновению ионов во внутренний раствор. Равновесный потенциал ионоселективного электрода зависит от концентрации определяемого иона в растворе. Поэтому, измерив электродный потенциал ионоселективного электрода с помощью электрода сравнения (с известной ЭДС), можно найти концентрацию ионов в растворе.
В качестве электрода сравнения чаще всего используют хлоросеребряный электрод (рис. 30, Б). Он состоит из стеклянной трубки 1, оканчивающейся капилляром с впаянной в него асбестовой нитью 2. Внутри стеклянной трубки помещена серебряная проволочка, покрытая тонким слоем хлористого серебра 6. Верхняя часть хлоросеребряной проволочки припаяна к многожильному медному проводу, оканчивающемуся клеммой 8. Нижняя часть хлоросеребряной проволочки помещена в растворе КСl или же имеет с ним контакт с помощью асбестовой нити - фитиля 7, смоченного насыщенным раствором хлористого калия, который заливают через небольшое отверстие, имеющееся в верхней части стеклянной трубки электрода. Асбестовые нити 2 и 7 служат также для затруднения диффузии внешнего раствора внутрь электрода, благодаря чему хлоросеребряная проволочка постоянно находится в насыщенном растворе хлористого калия, и поэтому потенциал электрода сравнения будет постоянным независимо от концентрации и состава внешнего раствора.
- Пищевые добавки для производителей спредов в России
- Запорная арматура из нержавейки от надежного поставщика ЕвроСтальСтрой
- В Липецком регионе «Фрагария» отгрузила первую партию товара
- В Черемшанском муниципалитете Татарстана открыли магазин и убойную площадку
- Стандартная светодиодная лента: основные характеристики и преимущества
- Ограждение для промышленных зон
- В Томском регионе запустили ещё один современный телятник
- В Томском регионе активно строят и покупают жилплощадь для семей, проживающих в сёлах
- Сравнение комплексных холодильных агрегатов и стандартного холодильного оборудования
- В Дагестане наладили первое в просии производство суперфосфата
- Уникальный тепличный комплекс получил земельный участок
- «Мираторг» будет воплощать в жизнь крупнейшую программу капиталовложений в Орловском регионе
- Производство нестандартных металлических конструкций
- В Татарстане будет действовать гигантский элеватор
- В Дагестане хотя возродить производство тулупа из овчины
- Valio буде экспортировать в Россию мороженое
- Вопросы по разведению и содержанию кур. Главные советы
- Молочная продукция Китая
- В городе Бор открыли новую козоферму
- Изготовители хлеба оренбургского региона объединились в Гильдию
- Продолжается обновление скотоводческой отрасли Оренбургского региона
- Алтайские компании производят фитнес-продукты
- Правительство Ярославского региона предложило новую инвестиционную площадку для запуска производства
- Виды торгового холодильного оборудования
- Льготный лимит перевозок омского зерна будет увеличен
- Сельские труженики Южного Казахстана наращивают объёмы производства аграрных товаров
- Холодоснабжение: как эффективно организовать важный процесс?
- В Дагестане продолжается закладка садов
- Крупнейший изготовитель курятины запускает инновационный бренд
- Примерно сорок гектаров теплиц передали в использование в нынешнем году